Kmen (chemie) - Strain (chemistry)
V chemii , jen molekuly zkušenosti kmen , když jeho chemická struktura podléhá určité napětí , které zvyšuje jeho vnitřní energie ve srovnání s kmenem bez referenční sloučeniny . Vnitřní energie molekuly se skládá z veškeré energie uložené v něm. Napjatá molekula má další množství vnitřní energie, což molekula bez napětí nemá. Tuto extra vnitřní energii nebo deformační energii lze přirovnat ke stlačené pružině . Podobně jako stlačený pramen musí být držen na místě, aby se zabránilo uvolňování jeho potenciální energie , molekula může být držena v energeticky nepříznivé konformaci vazbami uvnitř této molekuly. Bez vazeb, které drží konformaci na místě, by se uvolnila deformační energie.
souhrn
Termodynamika
Rovnováha dvou molekulárních konformací se stanoví na základě rozdílu Gibbsovy volné energie ze dvou konformací. Z tohoto rozdílu energií lze určit rovnovážnou konstantu pro dvě konformace.
Pokud dojde k poklesu Gibbsovy volné energie z jednoho stavu do druhého, je tato transformace spontánní a stav nižší energie je stabilnější . Vysoce napjatá molekulární konformace s vyšší energií se spontánně převede na molekulární konformaci s nižší energií.
Entalpie a entropie souvisí s Gibbsovou volnou energií prostřednictvím rovnice (při konstantní teplotě ):
Entalpie je obvykle důležitější termodynamickou funkcí pro stanovení stabilnější molekulární konformace. I když existují různé typy napětí, energie napětí spojená se všemi z nich je způsobena oslabením vazeb v molekule. Protože entalpie je obvykle důležitější, entropii lze často ignorovat. Není tomu tak vždy; pokud je rozdíl v entalpii malý, může mít entropie větší vliv na rovnováhu. Například n-butan má dvě možné konformace, anti a gauche . Antikonformace je stabilnější o 0,9 kcal mol −1 . Očekávali bychom, že butan je při pokojové teplotě zhruba 82% anti a 18% gauche. Existují však dvě možné gauche konformace a pouze jedna anti konformace. Entropie proto přispívá 0,4 kcal ve prospěch Gaucheho konformace. Zjistili jsme, že skutečná konformační distribuce butanu je 70% proti a 30% gauche při pokojové teplotě.
Určení molekulárního kmene
Standardní tepelné formování (Δ f H °) sloučeniny je popsána jako změna entalpie, když je sloučenina vytvořená z jejích oddělených prvků. Když se formovací teplo sloučeniny liší od predikce nebo referenční sloučeniny, lze tento rozdíl často přičíst kmenu. Například Δ f H ° pro cyklohexan je -29,9 kcal mol −1, zatímco Δ f H ° pro methylcyklopentan je -25,5 kcal mol −1 . Navzdory stejným atomům a počtu vazeb je methylcyklopentan energeticky vyšší než cyklohexan. Tento rozdíl v energii lze přičíst kmeni kruhu pětičlenného kruhu, který v cyklohexanu chybí. Experimentálně je deformační energie často určena pomocí spalovacích tepla, což je typicky snadno proveditelný experiment.
Určení energie kmene v molekule vyžaduje znalost očekávané vnitřní energie bez kmene. To lze provést dvěma způsoby. Nejprve by se dalo porovnat s podobnou sloučeninou, která postrádá kmen, jako v předchozím příkladu methylcyklohexanu . Bohužel může být často obtížné získat vhodnou sloučeninu. Alternativou je použít teorii přírůstku skupiny Benson . Dokud jsou pro atomy ve sloučenině k dispozici vhodné skupinové přírůstky, lze provést predikci A f H °. Pokud se experimentální Δ f H ° liší od predikovaného Δ f H °, lze tento rozdíl v energii přičíst deformační energii.
Druhy napětí
Kmen Van der Waals
Van der Waalsův kmen nebo sterický kmen nastává, když jsou atomy nuceny dostat se blíže, než dovolují jejich Van der Waalsovy poloměry . Van der Waalsův kmen je konkrétně považován za formu kmene, kde interagující atomy jsou od sebe vzdáleny alespoň čtyři vazby. Množství sterického kmene v podobných molekulách závisí na velikosti interagujících skupin; objemné terc-butylové skupiny zabírají mnohem více prostoru než methylové skupiny a často dochází k větším sterickým interakcím.
Účinky sterického kmene na reakci trialkylaminů a trimethylboronu byly studovány laureátem Nobelovy ceny Herbertem C. Brownem a kol. Zjistili, že jak se velikost alkylových skupin na aminu zvyšovala, rovnovážná konstanta se také snižovala. Posun rovnováhy byl přičítán sterickému kmenu mezi alkylovými skupinami aminu a methylovými skupinami na boru.
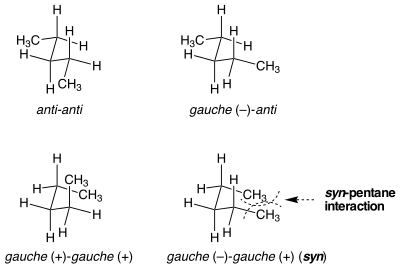
Kmen syn-pentan
Existují situace, kdy se zdánlivě identické konformace nerovná v deformační energii. Kmen syn-pentanu je příkladem této situace. Existují dva různé způsoby, jak dát obě vazby centrálního v n -pentanu do Gaucheovy konformace, z nichž jedna má o 3 kcal mol -1 vyšší energii než druhá. Když jsou dvě methylem substituované vazby otočeny z anti do gauche v opačných směrech, molekula předpokládá konformaci podobnou cyklopentanu, kde se dvě koncové methylové skupiny uvedou do blízkosti. Pokud se vazby otáčí stejným směrem, k tomu nedojde. Sterický kmen mezi dvěma koncovými methylovými skupinami odpovídá za rozdíl v energii mezi dvěma podobnými, ale velmi odlišnými konformacemi.
Allylický kmen
Allylický kmen nebo kmen A 1,3 je úzce spojen s kmenem syn-pentanu. Příklad allylického kmene lze vidět na sloučenině 2-pentenu . Je možné, že ethyl- substituentu olefinu se otáčet tak, že koncové methylové skupiny je uvedena v blízkosti vicinálního methylové skupiny olefinu. Tyto typy sloučenin obvykle mají lineárnější konformaci, aby se zabránilo sterickému napětí mezi substituenty.
1,3-diaxiální kmen
1,3-diaxiální kmen je další formou kmene podobného syn-pentanu. V tomto případě dochází ke kmenu v důsledku sterických interakcí mezi substituentem cyklohexanového kruhu ('α') a gaucheových interakcí mezi alfa substituentem a oběma methylenovými uhlíky dvě vazby od příslušného substituentu (tedy 1,3-diaxiální interakce). Pokud je substituent axiální , přivede se blízko k axiálnímu gama vodíku. Množství kmene je do značné míry závislé na velikosti substituentu a může být uvolněno zformováním do hlavní konformace křesla umístěním substituentu do ekvatoriální polohy. Rozdíl v energii mezi konformacemi se nazývá hodnota A a je dobře známý pro mnoho různých substituentů. Hodnota A je termodynamický parametr a původně byla měřena spolu s dalšími metodami pomocí Gibbsovy rovnice volné energie a například Meerwein – Ponndorf – Verleyova redukční / Oppenauerova oxidační rovnováha pro měření axiálních versus ekvatoriálních hodnot cyklohexanon / cyklohexanol ( 0,7 kcal mol −1 ).
Torzní napětí
Torzní napětí je odolnost proti kroucení vazby. V cyklických molekulách se mu také říká kmen Pitzer .
K torznímu namáhání dochází, když jsou atomy oddělené třemi vazbami umístěny do zastíněné konformace místo stabilnější odstupňované konformace. Rotační bariéra mezi střídavými konformacemi ethanu je přibližně 2,9 kcal mol −1 . Původně se věřilo, že překážka rotace je způsobena sterickými interakcemi mezi vicinálními vodíky, ale Van der Waalsův poloměr vodíku je příliš malý na to, aby tomu tak bylo. Nedávný výzkum ukázal, že odstupňovaná konformace může být stabilnější kvůli hyperkonjugativnímu účinku . Otočení od odstupňované konformace přeruší tuto stabilizační sílu.
Složitější molekuly, jako je butan, mají více než jednu možnou stupňovitou konformaci. Antikonformace butanu je přibližně o 0,9 kcal mol −1 (3,8 kJ mol −1 ) stabilnější než Gaucheho konformace. Obě tyto odstupňované konformace jsou mnohem stabilnější než zastínené konformace. Namísto hyperkonjugativního účinku, jako je ten v ethanu , je deformační energie v butanu způsobena jak sterickými interakcemi mezi methylovými skupinami, tak úhlovým napětím způsobeným těmito interakcemi.
Kruhový kmen
Podle teorie molekulárních vazeb VSEPR je upřednostňovaná geometrie molekuly taková, ve které jsou vazebné i nevazebné elektrony od sebe co nejdále. V molekulách je zcela běžné, že tyto úhly jsou ve srovnání s jejich optimální hodnotou poněkud stlačeny nebo rozšířeny. Tento kmen se označuje jako úhel nebo Baeyerův kmen. Nejjednoduššími příklady úhlového namáhání jsou malé cykloalkany, jako je cyklopropan a cyklobutan, které jsou diskutovány níže. Kromě toho v cyklických systémech často dochází k zatmění nebo Pitzerovu napětí. Tyto a možné transanulární interakce byly brzy shrnuty HC Brown jako vnitřní kmen nebo I-kmen. Molekulární mechanika nebo přístupy silového pole umožňují vypočítat takové deformační příspěvky, které pak mohou být korelovány např. S reakční rychlostí nebo rovnováhou. Mnoho reakcí alicyklických sloučenin, včetně rovnovážných, redoxních a solvolýzních reakcí, které jsou všechny charakterizovány přechodem mezi stavem sp2 a sp3 v reakčním centru, koreluje s odpovídajícími rozdíly v deformační energii SI (sp2 -sp3). Data odrážejí především nepříznivé vicinální úhly ve středních prstencích, jak dokládá prudký nárůst rychlostí redukce ketonů se zvyšujícím se SI (obrázek 1). Dalším příkladem je solvolýza tosylátů předmostí se rozdíly ve sterické energii mezi odpovídajícími bromidovými deriváty (sp3) a karbeniovým iontem jako sp2- model pro přechodový stav. (Obrázek 2)
| Velikost prstenu | Kmenová energie (kcal mol −1 ) | Velikost prstenu | Kmenová energie (kcal mol −1 ) | |
|---|---|---|---|---|
| 3 | 27.5 | 10 | 12.4 | |
| 4 | 26.3 | 11 | 11.3 | |
| 5 | 6.2 | 12 | 4.1 | |
| 6 | 0,1 | 13 | 5.2 | |
| 7 | 6.2 | 14 | 1.9 | |
| 8 | 9.7 | 15 | 1.9 | |
| 9 | 12.6 | 16 | 2.0 |
U acyklických sloučenin může v zásadě dojít k úhlovému namáhání, ale tento jev je vzácný.
Malé prsteny
Cyklohexan je považován za měřítko při určování kmene kruhu v cykloalkanech a je všeobecně přijímáno, že existuje jen malá nebo žádná energie kmene. Pro srovnání, menší cykloalkany mají díky vyššímu napětí mnohem vyšší energetickou hodnotu. Cyklopropan je analogický trojúhelníku, a tak má valenční úhly o velikosti 60 °, mnohem nižší, než je přednostní 109,5 ° o o sp 3 hybridizovaného uhlíku. Kromě toho jsou vodíky v cyklopropanu zastíněny. Cyklobutan zažívá podobný kmen s úhly vazby přibližně 88 ° (není úplně rovinný) a zastíněnými vodíky. Energie deformace cyklopropanu a cyklobutanu je 27,5 respektive 26,3 kcal mol −1 . Cyklopentan zažívá mnohem menší napětí, zejména v důsledku torzního napětí ze zatměných vodíků, a má deformační energii 6,2 kcal mol −1 .
Kruhový kmen může být v bicyklických systémech podstatně vyšší . Například bicykloklobutan , C 4 H 6 , je známý jako jedna z nejvíce namáhaných sloučenin, která je izolovatelná ve velkém měřítku; jeho deformační energie se odhaduje na 63,9 kcal mol −1 (267 kJ mol −1 ).
Transanulární kmen
Středně velké prstence (7–13 uhlíků) zažívají více energie napětí než cyklohexan, většinou kvůli odchylce od ideálních vicinálních úhlů nebo Pitzerova kmene. Výpočty molekulární mechaniky naznačují, že transanulární kmen, také známý jako kmen Prelog , nehraje zásadní roli. Transanulární reakce, jako je 1,5-posun v substitučních reakcích cyklooktanem, jsou však dobře známy.
Bicyklické systémy
Množství deformační energie v bicyklických systémech je obvykle součtem deformační energie v každém jednotlivém kruhu. Není tomu tak vždy, protože někdy fúze prstenů vyvolává určité napětí.
Kmen v alosterických systémech
V syntetických alosterických systémech existují typicky dva nebo více konformerů se rozdíly stability v důsledku příspěvků kmene. Pozitivní kooperativita je například důsledkem zvýšené vazby substrátu A na konformer C2, který je produkován vazbou efektorové molekuly E. Pokud má konformer C2 podobnou stabilitu jako jiný ekvilibrující konformátor C1, způsobení substrátu A způsobí vazba A na C2 také v nepřítomnosti efektoru E. Pouze pokud je stabilita konformeru C2 výrazně menší, což znamená, že při absenci efektoru E je populace C2 mnohem menší než populace C1, poměr K2/K1 který měří účinnost alosterického signálu se zvýší. Poměr K2/K1 může přímo souviset s rozdílem deformační energie mezi konformery C1 a C2; pokud je malá, vyšší koncentrace A se přímo váží na C2 a činí efektor E neefektivním. Navíc doba odezvy takových alosterických spínačů závisí na napětí stavu přechodových stavů konformních interkonverzí.