Wnt signalizační cesta - Wnt signaling pathway
The Wnt signální dráhy jsou skupina signálních transdukčních drah, které začínají s proteiny , které procházejí signály do buňky prostřednictvím buněčné povrchové receptory . Název Wnt je portmanteau vytvořený z názvů Wingless a Int-1. Signálové cesty Wnt používají buď blízkou komunikaci buňka-buňka ( parakrinní ), nebo komunikaci se stejnými buňkami ( autokrinní ). Jsou vysoce evolučně konzervovaní u zvířat, což znamená, že jsou si podobní napříč živočišnými druhy od ovocných mušek až po lidi.
Byly charakterizovány tři Wnt signální dráhy: kanonická Wnt dráha , nekanonická planární dráha polarity buněk a nekanonická dráha Wnt/vápník . Všechny tři cesty jsou aktivovány vazbou Wnt-proteinového ligandu na receptor Frizzledovy rodiny , který předává biologický signál proteinu Disheveled uvnitř buňky. Kanonická Wnt dráha vede k regulaci genové transkripce a předpokládá se, že je částečně negativně regulována genem SPATS1 . Nekanonická planární dráha polarity buněk reguluje cytoskelet, který je zodpovědný za tvar buňky. Nekanonická dráha Wnt/vápník reguluje vápník uvnitř buňky.
Wnt signalizace byla nejprve identifikována pro její roli v karcinogenezi , poté pro její funkci v embryonálním vývoji . Embryonální procesy, které řídí, zahrnují vzorování tělesné osy , specifikaci buněčného osudu , buněčnou proliferaci a migraci buněk . Tyto procesy jsou nezbytné pro správnou tvorbu důležitých tkání včetně kostí, srdce a svalů. Jeho role v embryonálním vývoji byla objevena, když genetické mutace v proteinech Wnt dráhy produkovaly abnormální embrya ovocných mušek . Pozdější výzkum zjistil, že geny zodpovědné za tyto abnormality také ovlivnily vývoj rakoviny prsu u myší. Signalizace Wnt také řídí regeneraci tkáně v dospělé kostní dřeni, kůži a střevě.
Klinický význam této cesty byl prokázán mutacemi, které vedou k různým chorobám, včetně rakoviny prsu a prostaty , glioblastomu , diabetu typu II a dalších. V posledních letech vědci hlásili první úspěšné použití inhibitorů dráhy Wnt v myších modelech onemocnění.
Historie a etymologie
Objev Wnt signalizace byl ovlivněn výzkumem onkogenních (rakovinotvorných) retrovirů . V roce 1982 Roel Nusse a Harold Varmus infikovali myši virem nádorového nádoru mléčné žlázy , aby zmutovaly myší geny a zjistily, které zmutované geny mohou způsobit nádory prsu. Identifikovali nový myší protoonkogen, který pojmenovali int1 (integrace 1).
Int1 je vysoce konzervativní u více druhů, včetně lidí a Drosophila . Jeho přítomnost v D. melanogaster vedla vědce v roce 1987 k objevu, že gen int1 v Drosophile byl ve skutečnosti již známý a charakterizovaný gen Drosophila známý jako Wingless (Wg). Vzhledem k tomu, že předchozí výzkum Christiane Nüsslein-Volhard a Erica Wieschause (který jim v roce 1995 získal Nobelovu cenu za fyziologii nebo medicínu) zavedl funkci Wg jako genu segmentové polarity, který se podílí na tvorbě osy těla během embryonálního vývoje , vědci zjistili, že savčí int1 objevený u myší je také zapojen do embryonálního vývoje.
Pokračující výzkum vedl k objevu dalších genů souvisejících s int1; protože však tyto geny nebyly identifikovány stejným způsobem jako int1, názvosloví genů int bylo neadekvátní. Rodina int/Wingless se tedy stala rodinou Wnt a int1 se stala Wnt1. Název Wnt je portmanteau of int a Wg a znamená „Wingless-related integration site“.
Bílkoviny
Wnt zahrnuje různorodou rodinu sekretovaných lipidem modifikovaných signalizačních glykoproteinů o délce 350–400 aminokyselin . Lipidová modifikace všech Wnt je palmitoleoylace jediného zcela konzervovaného serinového zbytku. Palmitoleoylation je nutné, protože je to vyžadováno pro Wnt vázat se na jeho nosný protein Wntless (WLS), takže může být dopravena do plazmatické membrány pro sekreci, a to umožňuje, aby protein Wnt vázat jeho receptoru Frizzled Wnt proteiny také podstoupit glykosylaci , který přikládá uhlohydráty , aby byla zajištěna správná sekrece. Při signalizaci Wnt tyto proteiny působí jako ligandy k aktivaci různých Wnt cest parakrinními a autokrinními cestami.
Tyto bílkoviny jsou mezi druhy vysoce konzervované. Lze je nalézt u myší, lidí, Xenopus , zebrafish , Drosophila a mnoha dalších.
| Druh | Wnt proteiny |
|---|---|
| Homo sapiens | WNT1 , WNT2 , WNT2B , WNT3 , WNT3A , WNT4 , WNT5A , WNT5B , WNT6 , WNT7A , WNT7B , WNT8A , WNT8B , WNT9A , WNT9B , WNT10A , WNT10B , WNT10B , WNT10B |
| Mus musculus (identické proteiny jako u H. sapiens) | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt6, Wnt7A, Wnt7B, Wnt8A, Wnt8B, Wnt9A, Wnt9B, Wnt10A, Wnt10B, Wnt11, Wnt16 |
| Xenopus | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt7A, Wnt7B, Wnt8A, Wnt8B, Wnt10A, Wnt10B, Wnt11, Wnt11R |
| Danio rerio | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt6, Wnt7A, Wnt7B, Wnt8A, Wnt8B, Wnt10A, Wnt10B, Wnt11, Wnt16 |
| Drosophila | Wg, DWnt2, DWnt3/5, DWnt 4, DWnt6, WntD/DWnt8, DWnt10 |
| Hydra | hywnt1, hywnt5a, hywnt8, hywnt7, hywnt9/10a, hywnt9/10b, hywnt9/10c, hywnt11, hywnt16 |
| C. elegans | máma-2, lin-44, egl-20, cwn-1, cwn-2 |
Mechanismus

Nadace
Wnt signalizace začíná, když se Wnt protein váže na N-koncovou extracelulární doménu bohatou na cystein receptoru rodiny Frizzled (Fz). Tyto receptory sedmkrát překlenují plazmatickou membránu a tvoří odlišnou rodinu receptorů spojených s G-proteinem (GPCR). Aby se však usnadnila signalizace Wnt, mohou být vedle interakce mezi proteinem Wnt a receptorem Fz vyžadovány ko- receptory. Příklady zahrnují protein související s lipoproteinovým receptorem ( LRP ) -5/6, receptorovou tyrosinkinázu (RTK) a ROR2 . Po aktivaci receptoru je signál odeslán do fosfoproteinu Disheveled (Dsh), který se nachází v cytoplazmě . Tento signál je přenášen přímou interakcí mezi Fz a Dsh. Dsh proteiny jsou přítomny ve všech organismech a všechny sdílejí následující vysoce konzervované proteinové domény : amino-koncovou DIX doménu, centrální PDZ doménu a karboxy-koncovou DEP doménu . Tyto různé domény jsou důležité, protože po Dsh se signál Wnt může rozvětvit do více cest a každá cesta interaguje s jinou kombinací tří domén.
Kanonické a nekanonické cesty
Tři nejlépe charakterizované signální dráhy Wnt jsou kanonická dráha Wnt, nekanonická dráha polarity planárních buněk a nekanonická dráha Wnt/vápník. Jak jejich názvy napovídají, tyto cesty patří do jedné ze dvou kategorií: kanonické nebo nekanonické. Rozdíl mezi kategoriemi je v tom, že kanonická cesta zahrnuje protein β-katenin, zatímco nekanonická dráha funguje nezávisle na ní.
Kanonická cesta
Kanonická Wnt dráhy (nebo Wnt / β-katenin dráha) je Wnt dráha, která způsobuje akumulaci p-katenin v cytoplazmě a jeho případného translokaci do jádra, působit jako transkripční koaktivátoru z transkripčních faktorů , které patří do TCF / Rodina LEF . Bez Wnt by se beta-katenin nehromadil v cytoplazmě, protože destrukční komplex by jej normálně degradoval. Tento destrukční komplex zahrnuje následující proteiny: Axin , adenomatosis polyposis coli (APC), protein fosfatáza 2A (PP2A), glykogen syntáza kináza 3 (GSK3) a kasein kináza 1 α (CK1α). Degraduje β-katenin zaměřením na ubikvitinaci , který jej následně pošle do proteazomu, aby byl štěpen. Jakmile však Wnt váže Fz a LRP5 / 6 , funkce komplexu destrukce se naruší. To je způsobeno tím, že Wnt způsobuje translokaci negativního Wnt regulátoru Axin a destrukčního komplexu na plazmatickou membránu. Fosforylace jinými proteiny v destrukčním komplexu následně váže Axin na cytoplazmatický ocas LRP5/6. Axin se de-fosforyluje a jeho stabilita a hladiny se snižují. Dsh se poté aktivuje fosforylací a jeho domény DIX a PDZ inhibují aktivitu GSK3 destrukčního komplexu. To umožňuje beta-katenin akumulovat a lokalizovat se do jádra a následně indukovat buněčnou odpověď prostřednictvím genové transdukce spolu s transkripčními faktory TCF/LEF (faktor T-buněk/faktor zvyšující lymfoid). β-katenin rekrutuje další transkripční koaktivátory, jako BCL9 , Pygopus a Parafibromin/Hyrax. Složitost transkripčního komplexu sestaveného β-kateninem se začíná objevovat díky novým vysoce výkonným studiím proteomiky . Sjednocená teorie o tom, jak β ‐ katenin řídí expresi cílového genu, však stále chybí a tkáňově specifičtí hráči mohou pomoci β ‐ katenin definovat jeho cílové geny. Extensivity z beta-katenin interagujících proteinů komplikuje pochopení: β-katenin může být přímo fosforylovanou na Ser552 podle Akt, což způsobuje jeho disociaci od mezibuněčných kontaktů a akumulaci v cytosolu, poté 14-3-3ζ interaguje s p-katenin (pSer552) a zlepšuje jeho jadernou translokaci. BCL9 a Pygopus byly ve skutečnosti vybaveny několika funkcemi nezávislými na beta-kateninu (tedy pravděpodobně nezávislými na Wnt signalizaci).
Nekanonické dráhy
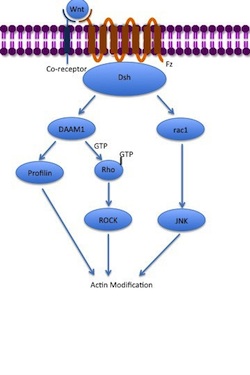
Dráha nekanonické planární buněčné polarity (PCP) nezahrnuje β-katenin. Jako koreceptor nepoužívá LRP-5/6 a předpokládá se, že používá NRH1 , Ryk , PTK7 nebo ROR2 . Dráha PCP se aktivuje navázáním Wnt na Fz a jeho koreceptor. Receptor poté rekrutuje Dsh , který využívá své domény PDZ a DIX k vytvoření komplexu s aktivátorem morfogeneze 1 spojeným s Disheveled ( DAAM1 ). Daam1 poté aktivuje malý G-protein Rho prostřednictvím guaninového výměnného faktoru. Rho aktivuje Rho-asociovanou kinázu (ROCK), která je jedním z hlavních regulátorů cytoskeletu . Dsh také tvoří komplex s rac1 a zprostředkovává vazbu profilinu na aktin . Rac1 aktivuje JNK a může také vést k polymeraci aktinu . Profilinová vazba na aktin může mít za následek restrukturalizaci cytoskeletu a gastrulaci .
Nekanonická dráha Wnt/vápník také neobsahuje β-katenin. Jeho úkolem je pomoci regulovat uvolňování vápníku z endoplazmatického retikula (ER) za účelem kontroly nitrobuněčných hladin vápníku. Stejně jako ostatní dráhy Wnt po navázání ligandu aktivovaný receptor Fz přímo interaguje s Dsh a aktivuje specifické domény Dsh-proteinu. Domény zapojené do signalizace Wnt/vápník jsou domény PDZ a DEP. Na rozdíl od jiných cest Wnt však receptor Fz přímo interaguje s trimerním G-proteinem. Tato společná stimulace Dsh a G-proteinu může vést k aktivaci buď PLC, nebo cGMP-specifického PDE . Pokud je PLC aktivováno, komponenta plazmatické membrány PIP2 se štěpí na DAG a IP3 . Když IP3 váže svůj receptor na ER, uvolňuje se vápník. Zvýšené koncentrace vápníku a DAG mohou aktivovat Cdc42 prostřednictvím PKC . Cdc42 je důležitým regulátorem ventrálního vzorování. Zvýšený vápník také aktivuje kalcineurin a CaMKII . CaMKII indukuje aktivaci transkripčního faktoru NFAT , který reguluje adhezi buněk, migraci a separaci tkání. Calcineurin aktivuje kinázu TAK1 a NLK , která může interferovat se signalizací TCF/β-Catenin v kanonické Wnt dráze. Je -li však aktivována PDE, uvolňování vápníku z ER je inhibováno. PDE to zprostředkovává prostřednictvím inhibice PKG, což následně způsobuje inhibici uvolňování vápníku.
Integrovaná cesta Wnt
Binární rozlišení kanonických a nekanonických signálních cest Wnt bylo podrobeno zkoumání a byla navržena integrovaná, konvergentní cesta Wnt. Byly nalezeny určité důkazy pro jeden Wnt ligand (Wnt5A). Důkaz pro konvergentní Wnt signální dráhu, která ukazuje integrovanou aktivaci Wnt/Ca2+ a Wnt/p-kateninové signalizace pro více ligandů Wnt, byl popsán v savčích buněčných liniích.
Jiné cesty
Wnt signalizace také reguluje řadu dalších signálních cest, které nebyly tak rozsáhle objasněny. Jedna taková cesta zahrnuje interakci mezi Wnt a GSK3. Během buněčného růstu může Wnt inhibovat GSK3, aby aktivoval mTOR v nepřítomnosti β-kateninu. Wnt však může také sloužit jako negativní regulátor mTOR prostřednictvím aktivace nádorového supresoru TSC2 , který je upregulován interakcí Dsh a GSK3. Během myogeneze používá Wnt k aktivaci genů MyoD a Myf5 PA a CREB . Wnt také působí ve spojení s Rykem a Src, aby umožnil regulaci odpuzování neuronů během axonálního vedení . Wnt reguluje gastrulaci, když CK1 slouží jako inhibitor Rap1-ATPázy za účelem modulace cytoskeletu během gastrulace. Další regulace gastrulace je dosaženo, když Wnt používá ROR2 spolu s dráhou CDC42 a JNK k regulaci exprese PAPC . Dsh může také interagovat s aPKC, Pa3 , Par6 a LGl za účelem kontroly polarity buněk a vývoje cytoskeletu mikrotubulů . Přestože se tyto cesty překrývají se součástmi spojenými se signalizací PCP a Wnt/Calcium, jsou považovány za odlišné cesty, protože produkují různé reakce.
Nařízení
Aby byla zajištěna správná funkce, signalizace Wnt je neustále regulována v několika bodech podél signálních drah. Například Wnt proteiny jsou palmitoylované . Proteinový dikobraz zprostředkovává tento proces, což znamená, že pomáhá regulovat, kdy je Wnt ligand vylučován určením, kdy je plně vytvořen. Sekrece je dále kontrolována proteiny, jako je GPR177 (wntless) a rovnoměrnost přerušena a komplexy, jako je retromer komplex.
Po sekreci lze ligandu zabránit v dosažení jeho receptoru vazbou proteinů, jako jsou stabilizátory Dally a glypican 3 (GPC3), které inhibují difúzi. V rakovinných buňkách jsou jak heparansulfátové řetězce, tak jádrový protein GPC3 zapojeny do regulace vazby Wnt a aktivace pro buněčnou proliferaci. Wnt rozpoznává strukturu heparan sulfátu na GPC3, která obsahuje IdoA2S a GlcNS6S, a 3-O-sulfatace v GlcNS6S3S zvyšuje vazbu Wnt na glypican sulfát heparanu. Byla identifikována doména bohatá na cystein na N-laloku GPC3, která tvoří hydrofobní drážku vázající Wnt včetně fenylalaninu-41, který interaguje s Wnt. Blokování vazebné domény Wnt pomocí nanočástice zvané HN3 může inhibovat aktivaci Wnt.
Na receptoru Fz může vazba proteinů jiných než Wnt antagonizovat signalizaci. Mezi specifické antagonisty patří Dickkopf (Dkk), Wnt inhibiční faktor 1 (WIF-1), vylučované proteiny související s Frizzled (SFRP), Cerberus , Frzb , Wise , SOST a Nahá kutikula . Ty představují inhibitory Wnt signalizace. Jako aktivátory však působí i jiné molekuly. Norrin a R-Spondin2 aktivují signalizaci Wnt v nepřítomnosti Wnt ligandu.
Interakce mezi signálními cestami Wnt také regulují signalizaci Wnt. Jak již bylo zmíněno, dráha Wnt/vápník může inhibovat TCF/β-katenin, což brání kanonické signalizaci dráhy Wnt. Prostaglandin E2 je nezbytným aktivátorem kanonické signální dráhy Wnt. Interakce PGE2 s jeho receptory E2/E4 stabilizuje β-katenin prostřednictvím cAMP/PKA zprostředkované fosforylace. Syntéza PGE2 je nezbytná pro procesy zprostředkované signalizací Wnt, jako je regenerace tkáně a kontrola populace kmenových buněk u zebrafish a myší. Je zajímavé, že nestrukturované oblasti několika nadrozměrných jiskrově neuspořádaných proteinů hrají zásadní roli při regulaci signalizace Wnt.
Vyvolané reakce buněk
Embryonální vývoj
Wnt signalizace hraje zásadní roli v embryonálním vývoji. Působí na obratlovcích i bezobratlých , včetně lidí, žab, zebrafish, C. elegans , Drosophila a dalších. Poprvé byl nalezen v polaritě segmentu Drosophila, kde pomáhá stanovit přední a zadní polaritu. Je zapojen do dalších vývojových procesů . Jak naznačuje její funkce u Drosophily , hraje klíčovou roli při tvorbě osy těla , zejména při tvorbě předozadní a dorsoventrální osy. Podílí se na indukci buněčné diferenciace k rychlé tvorbě důležitých orgánů, jako jsou plíce a vaječníky . Wnt dále zajišťuje vývoj těchto tkání správnou regulací buněčné proliferace a migrace . Signálové funkce Wnt lze rozdělit na vzorování os, specifikaci buněčného osudu, buněčnou proliferaci a migraci buněk.
Vzory os
V raném vývoji embryí je tvorba primárních tělesných os rozhodujícím krokem při vytváření celkového tělesného plánu organismu. Osy zahrnují předozadní osu, dorsoventrální osu a pravolevou osu. Wnt signalizace se podílí na tvorbě předozadní a dorsoventrální (DV) osy. Wnt signalizační aktivitu v předozadním vývoji lze pozorovat u savců, ryb a žab. U savců je primitivní pruh a dalších okolních tkání výrobě morfogenní sloučeniny Wnts, BMP , FGF , přiřazených uzlům a kyselina retinová stanovit zadní oblast během pozdní gastrula . Tyto proteiny tvoří koncentrační gradienty. Oblasti s nejvyšší koncentrací vytvářejí zadní oblast, zatímco oblasti s nejnižší koncentrací označují přední oblast. U ryb a žab způsobuje β-katenin produkovaný kanonickou signalizací Wnt vytváření organizačních center, která vedle BMP vyvolávají zadní formaci. Wnt zapojení do tvorby osy DV lze vidět na aktivitě formace Spemannova organizátoru , který stanoví hřbetní oblast. Kanonická Wnt signalizace produkce β-katenin indukuje tvorbu tohoto organizéru aktivací genů twin a siamois. Podobně při ptačí gastrulaci buňky Kollerova srpu exprimují různé mezodermální markerové geny, které umožňují rozdílný pohyb buněk během tvorby primitivního pruhu. Za tento pohyb je zodpovědná signalizace Wnt aktivovaná FGF.
Wnt signalizace se také podílí na tvorbě os konkrétních částí těla a orgánových systémů později ve vývoji. U obratlovců sonický ježek (Shh) a Wnt morfogenetické signální gradienty stanoví dorsoventrální osu centrálního nervového systému během axiálního vzorování neurální trubice . Signalizace High Wnt určuje hřbetní oblast, zatímco signalizace High Shh označuje ventrální oblast. Wnt se podílí na tvorbě DV centrálního nervového systému prostřednictvím svého zapojení do vedení axonů . Wnt proteiny vedou axony míchy v předozadním směru. Wnt se také podílí na tvorbě osy končetiny DV. Wnt7a konkrétně pomáhá vytvářet hřbetní vzorci vyvíjející se končetiny.
V modelu vývoje embryonálních diferenciačních vln hraje Wnt klíčovou roli jako součást signalizačního komplexu v kompetentních buňkách připravených k diferenciaci. Wnt reaguje na aktivitu cytoskeletu, stabilizuje počáteční změnu vytvořenou procházející vlnou kontrakce nebo expanze a současně signalizuje jádro pomocí svých různých signálních cest, na které vlně se jednotlivá buňka podílela. Wnt aktivita tím zesiluje mechanická signalizace, ke které dochází během vývoje.
Specifikace osudu buňky
Specifikace buněčného osudu nebo diferenciace buněk je proces, kde se nediferencované buňky mohou stát specializovanějším typem buněk. Wnt signalizace indukuje diferenciaci pluripotentních kmenových buněk na mezodermové a endodermové progenitorové buňky . Tyto progenitorové buňky se dále diferencují na buněčné typy, jako jsou linie hladkých svalů endoteliálních, srdečních a cévních. Wnt signalizace indukuje tvorbu krve z kmenových buněk. Wnt3 konkrétně vede k mezodermovým buňkám s hematopoetickým potenciálem. Wnt1 antagonizuje nervovou diferenciaci a je hlavním faktorem vlastní obnovy nervových kmenových buněk. To umožňuje regeneraci buněk nervového systému, což je dalším důkazem role při podpoře proliferace nervových kmenových buněk. Wnt signalizace se podílí na určování zárodečných buněk , specifikaci střevní tkáně, vývoji vlasových folikulů, vývoji plicní tkáně, diferenciaci buněk trupu neurální lišty , vývoji nefronů, vývoji vaječníků a určování pohlaví . Wnt signalizace také antagonizuje tvorbu srdce a ukázalo se, že inhibice Wnt je kritickým induktorem srdeční tkáně během vývoje a k výrobě kardiomyocytů z pluripotentních kmenových buněk se běžně používají inhibitory Wnt s malou molekulou.
Buněčná proliferace
Aby došlo k masové diferenciaci buněk potřebných k vytvoření specifikovaných buněčných tkání různých organismů, musí dojít k proliferaci a růstu embryonálních kmenových buněk . Tento proces je zprostředkován kanonickou Wnt signalizací, která zvyšuje jaderný a cytoplazmatický β-katenin. Zvýšený beta-katenin může iniciovat transkripční aktivaci proteinů, jako je cyklin Dl a c-myc , které řídí fázový přechod G1 na S v buněčném cyklu . Vstup do S fáze způsobuje replikaci DNA a nakonec mitózu , které jsou zodpovědné za buněčnou proliferaci. Toto zvýšení proliferace je přímo spárováno s diferenciací buněk, protože jak kmenové buňky proliferují, také se diferencují. To umožňuje celkový růst a vývoj specifických tkáňových systémů během embryonálního vývoje. To je zřejmé v systémech, jako je oběhový systém, kde Wnt3a vede k proliferaci a expanzi hematopoetických kmenových buněk potřebných pro tvorbu červených krvinek.
Biochemie rakovinných kmenových buněk se jemně liší od ostatních nádorových buněk. Tyto takzvané buňky závislé na Wnt unesou a závisí na neustálé stimulaci Wnt dráhy, aby podpořily svůj nekontrolovaný růst, přežití a migraci. U rakoviny se Wnt signalizace může stát nezávislou na pravidelných podnětech, a to prostřednictvím mutací v následných onkogenech a tumor supresorových genech, které se trvale aktivují, přestože normální receptor nedostal signál. β-katenin se váže na transkripční faktory, jako je protein TCF4, a v kombinaci molekuly aktivují potřebné geny. LF3 silně inhibuje tuto vazbu in vitro v buněčných liniích a snižuje růst nádoru v myších modelech. Zabránilo replikaci a snížilo jejich migrační schopnost, a to vše bez ovlivnění zdravých buněk. Po léčbě nezůstaly žádné rakovinné kmenové buňky. Tento objev byl výsledkem „ racionálního návrhu léčiv “ zahrnujícího technologie AlphaScreens a ELISA.
Migrace buněk
Migrace buněk během embryonálního vývoje umožňuje vytvoření os těla, tvorbu tkáně, indukci končetiny a několik dalších procesů. Wnt signalizace pomáhá zprostředkovat tento proces, zejména během konvergentního prodloužení. Pro správné konvergentní prodloužení během gastrulace je vyžadována signalizace jak z Wnt PCP cesty, tak z kanonické Wnt dráhy. Konvergentní rozšíření je dále regulováno dráhou Wnt/vápník, která po aktivaci blokuje konvergentní rozšíření. Wnt signalizace také indukuje migraci buněk v pozdějších fázích vývoje prostřednictvím řízení migračního chování neuroblastů , buněk neurálního lišty , myocytů a tracheálních buněk.
Signalizace Wnt je zapojena do dalšího klíčového migračního procesu známého jako epiteliálně-mezenchymální přechod (EMT). Tento proces umožňuje epiteliálním buňkám transformovat se do mezenchymálních buněk, takže již nejsou drženy na svém místě v lamininu . Zahrnuje down-regulaci kadherinu, aby se buňky mohly oddělit od lamininu a migrovat. Wnt signalizace je induktorem EMT, zejména ve vývoji mléčné žlázy.
Citlivost na inzulín
Inzulin je peptidový hormon zapojený do homeostázy glukózy v určitých organizmech. Konkrétně to vede k upregulaci transportérů glukózy v buněčné membráně, aby se zvýšil příjem glukózy z krevního oběhu . Tento proces je částečně zprostředkován aktivací signalizace Wnt/β-katenin, která může zvýšit citlivost buňky na inzulín. Zejména Wnt10b je protein Wnt, který zvyšuje tuto citlivost v buňkách kosterního svalstva.
Klinické důsledky
Rakovina
Od svého prvního objevu má signalizace Wnt souvislost s rakovinou . Když byl Wnt1 objeven, byl poprvé identifikován jako protoonkogen v myším modelu rakoviny prsu. Skutečnost, že Wnt1 je homolog Wg, ukazuje, že se podílí na embryonálním vývoji, který často vyžaduje rychlé dělení a migraci buněk. Nesprávná regulace těchto procesů může vést k rozvoji nádoru prostřednictvím nadměrné buněčné proliferace.
Aktivita dráhy Canonical Wnt se podílí na vývoji benigních a maligních nádorů prsu. Role Wnt dráhy v nádorové chemorezistenci byla také dobře zdokumentována, stejně jako její role v udržování odlišné subpopulace buněk iniciujících rakovinu. Jeho přítomnost je odhalena zvýšenými hladinami beta-kateninu v jádru a/nebo cytoplazmě, které lze detekovat pomocí imunohistochemického barvení a Western blotu . Zvýšená exprese β-katenin koreluje se špatnou prognózou u pacientek s rakovinou prsu. Tato akumulace může být způsobena faktory, jako jsou mutace v β-kateninu, nedostatky v komplexu destrukce β-kateninu, nejčastěji mutacemi ve strukturálně neuspořádaných oblastech APC , nadměrná exprese Wnt ligandů, ztráta inhibitorů a/nebo snížená aktivita regulačních dráhy (jako je dráha Wnt/vápník). Nádory prsu mohou metastazovat v důsledku zapojení Wnt do EMT. Výzkum zaměřený na metastázy bazálně podobného karcinomu prsu do plic ukázal, že represe signalizace Wnt/β-katenin může zabránit EMT, které může inhibovat metastázy.
Wnt signalizace se podílí na vývoji dalších druhů rakoviny. Změny v expresi CTNNB1 , což je gen, který kóduje β-katenin, lze měřit u rakoviny prsu, kolorektálního karcinomu , melanomu , prostaty , plic a dalších. Zvýšená exprese Wnt ligandových proteinů, jako jsou Wnt1, Wnt2 a Wnt7A, byla pozorována při vývoji glioblastomu , rakoviny jícnu a rakoviny vaječníků . Mezi další proteiny, které způsobují více typů rakoviny bez správné funkce, patří ROR1, ROR2, SFRP4 , Wnt5A, WIF1 a proteiny z rodiny TCF/LEF.
Spojení mezi PGE2 a Wnt naznačuje, že zvýšení PGE2 související s chronickým zánětem může vést k aktivaci dráhy Wnt v různých tkáních, což má za následek karcinogenezi .
Diabetes typu II
Diabetes mellitus 2. typu je běžné onemocnění, které způsobuje sníženou sekreci inzulínu a zvýšenou inzulínovou rezistenci na periferii. Výsledkem je zvýšená hladina glukózy v krvi nebo hyperglykémie , která může být smrtelná, pokud není léčena. Vzhledem k tomu, že Wnt signalizace je zapojena do citlivosti na inzulín, může být zapojena porucha její dráhy. Nadměrná exprese Wnt5b například může zvýšit náchylnost kvůli jeho roli v adipogenezi , protože obezita a diabetes typu II mají vysokou komorbiditu . Wnt signalizace je silným aktivátorem mitochondriální biogeneze . To vede ke zvýšené produkci reaktivních druhů kyslíku (ROS), o nichž je známo, že způsobují poškození DNA a buněk. Toto poškození vyvolané ROS je významné, protože může způsobit akutní jaterní inzulínovou rezistenci nebo inzulinovou rezistenci vyvolanou poraněním. Mutace v transkripčních faktorech spojených se signalizací Wnt, jako je TCF7L2 , jsou spojeny se zvýšenou citlivostí.
Viz také
- AXIN1
- GSK-3
- Řízení vypadávání vlasů
- Bezkřídlý lokalizační prvek 3 (WLE3)
- Protein 1 indukovatelné signální dráhy WNT1 (WISP1)
- Protein 2 indukovatelné signální dráhy WNT1 (WISP2)
- Protein 3 indukovatelné signální dráhy WNT1 (WISP3)
Reference
Další čtení
- Miloševič V a kol. (Leden 2020). „Autokrinní obvody Wnt/IL-1β/IL-8 kontrolují chemorezistenci v buňkách iniciujících mezoteliom indukcí ABCB5“ . Int. J. Rak . 146 (1): 192–207. doi : 10,1002/ijc.32419 . PMID 31107974 . S2CID 160014053 .
- Dinasarapu AR, Saunders B, Ozerlat I, Azam K, Subramaniam S (červen 2011). „Stránky molekul signalizační brány-perspektiva datového modelu“ . Bioinformatika . 27 (12): 1736–8. doi : 10,1093/bioinformatika/btr190 . PMC 3106186 . PMID 21505029 .
externí odkazy
- Wnt+Proteins at US National Library of Medicine Medical Subject Headings (MeSH)