Myxobolus cerebralis -Myxobolus cerebralis
| Myxobolus cerebralis | |
|---|---|
|
|
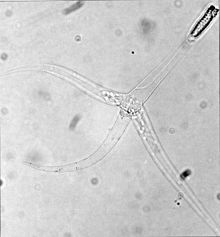
| Triaktinomyxonová fáze Myxobolus cerebralis - všimněte si tří „ocásků“ | |
|
Vědecká klasifikace |
|
| Království: | Animalia |
| Kmen: | Cnidaria |
| Třída: | Myxosporea |
| Objednat: | Bivalvulida |
| Rodina: | Myxobolidae |
| Rod: | Myxobolus |
| Druh: |
M. cerebralis
|
| Binomické jméno | |
|
Myxobolus cerebralis
Hofer , 1903
|
|
| Synonyma | |
|
Myxosoma cerebralis |
|
Myxobolus cerebralis je myxosporean parazit z lososovitých ryb ( losos , pstruh , a jejich spojenci), který vyvolává víření onemocnění v chovaných lososů a pstruhů a také v populacích divokých ryb . Poprvé byl popsán u pstruha duhového v Německu před sto lety, ale jeho rozsah se rozšířil a objevil se ve většině Evropy (včetně Ruska), Spojených státech, Jižní Africe, Kanadě a dalších zemích. V roce 1980, M. cerebralis bylo zjištěno, že vyžadují tubificid máloštětinatci (druh segmentového šnekového ) dokončit svůj životní cyklus. Parazit nakazí své hostitele svými buňkami poté, co je probodne polárními vlákny vysunutými ztobolek podobných nematocystám .
Vířivá nemoc postihuje mladé ryby (prstence a plůdky) a způsobuje deformaci skeletu a neurologické poškození. Ryby místo normálního plavání „víří“ vpřed nepohodlným vzorkem podobným vývrtce, obtížně se krmí a jsou náchylnější k predátorům . Úmrtnost je vysoká u prstů, až 90% infikovaných populací, a ty, které přežijí, jsou deformovány parazity sídlícími v jejich chrupavce a kosti . Fungují jako rezervoár parazita, který se po smrti ryby uvolňuje do vody. M. cerebralis je jedním z ekonomicky nejdůležitějších myxozoanů v rybách a také jedním z nejvíce patogenních. Byl to první myxosporejec, jehož patologie a symptomy byly vědecky popsány. Parazit není přenosný na člověka.
Taxonomie
Taxonomie a pojmenování obou M. cerebralis , a myxozoans obecně mají složité historie. Původně se předpokládalo, že infikuje mozek ryb (odtud specifický epithet cerebralis ) a nervový systém , ačkoli se brzy zjistilo, že primárně infikuje chrupavku a kosterní tkáň . Pokusy o změnu názvu na Myxobolus chondrophagus , který by přesněji popisoval organismus, ztroskotaly na názvoslovných pravidlech . Později bylo zjištěno , že organismy dříve nazývané Triactinomyxon dubium a T. gyrosalmo ( třída Actinosporea ) jsou ve skutečnosti triaktinomyxonovými stádii M. cerebralis , jejichž životní cyklus byl rozšířen o triaktinomyxonové stadium. Podobně byli do životních cyklů různých myxosporeanů vloženi další aktinosporejci.
Dnes jsou myxozoani, dříve považovaní za mnohobuněčné prvoky , většinou vědců považováni za zvířata , i když se jejich status oficiálně nezměnil. Nedávné molekulární studie naznačují, že jsou příbuzné Bilaterii nebo Cnidarii , přičemž Cnidaria je morfologicky bližší, protože obě skupiny mají extrudivní vlákna. Bilaterie byly v některých genetických studiích poněkud blíže, ale bylo zjištěno, že používaly vzorky kontaminované materiálem z hostitelského organismu a studie z roku 2015 potvrzuje, že jsou cnidariáni.
Morfologie
M. cerebralis má mnoho různých fází od jednotlivých buněk po relativně velké spóry, ne všechny byly podrobně studovány.
Fáze triaktinomyxonu
Fáze, které infikují ryby, nazývané spory triaktinomyxonu , jsou vyrobeny z jediného stylu, který je dlouhý asi 150 mikrometrů (μm), a tří procesů nebo „ocásků“, z nichž každý je dlouhý přibližně 200 mikrometrů. Balíček sporoplazmy na konci stylu obsahuje 64 zárodečných buněk obklopených buněčnou obálkou. Existují také tři polární kapsle , z nichž každá obsahuje stočený polární filament dlouhý mezi 170 a 180 μm. Polární filamenty jak v této fázi, tak ve fázi myxospore (viz obrázek výše) rychle vystřelují do těla hostitele a vytvářejí otvor, kterým může vstoupit sporoplazma.
Sporoplazmatická fáze
Při kontaktu s rybími hostiteli a vypálení polárních kapslí sporoplazma obsažená v centrálním stylu triaktinomyxonu migruje do epitelu nebo střevní výstelky. Za prvé, tato sporoplazma podléhá mitóze, aby produkovala více amoeboidních buněk, které migrují do hlubších vrstev tkáně, aby dosáhly mozkové chrupavky.
Myxosporská fáze
Myxospory, které se vyvíjejí ze sporogonických buněčných stádií uvnitř hostitelů ryb, jsou čočkovité. Mají průměr asi 10 mikrometrů a jsou vyrobeny ze šesti buněk. Dva z těchto buněk tvoří polární kapsle, dva splývají a tvoří binukleátovou sporoplazmu a dva tvoří ochranné chlopně. Myxospory jsou infekční vůči oligochaetům a nacházejí se mezi zbytky natrávené rybí chrupavky. Často je obtížné je odlišit od příbuzných druhů kvůli morfologické podobnosti napříč rody . Ačkoli M. cerebralis je jediným myxosporejcem, který byl kdy nalezen v lososové chrupavce, v kůži, nervovém systému nebo svalech mohou být přítomny další vizuálně podobné druhy .
Životní cyklus
Myxobolus cerebralis má dvouhostitelský životní cyklus zahrnující lososovité ryby a tubificidní oligochaety. Zatím jediným červem, o kterém je známo, že je citlivý na infekci M. cerebralis, je Tubifex tubifex , ačkoli vědci v současné době nazývají T. tubifex ve skutečnosti více než jeden druh. Za prvé, myxospory jsou přijímány tubificidními červy. V střevní lumen červa, výtrusy vytlačovat své polární kapsle a připojit k střevním epitelu by polárními vlákny . Skořepinové chlopně se pak otevřou podél linie stehu a binukleátová zárodečná buňka pronikne mezi střevní epiteliální buňky červa. Tato buňka se množí a produkuje mnoho améboidních buněk nepohlavním štěpením buněk zvaným merogonie . V důsledku procesu násobení se může infikovat mezibuněčný prostor epiteliálních buněk ve více než 10 sousedních červích segmentech.
Přibližně 60–90 dní po infekci procházejí stádia pohlavních buněk parazita sporogenezí a vyvíjejí se do pansporocyst , z nichž každá obsahuje osm spór triaktinomyxonového stádia. Tyto spory se uvolňují z konečníku oligochaete do vody. Alternativně se ryba může nakazit požitím infikovaného oligocheta. Infikované tubificidy mohou uvolňovat triaktinomyxony po dobu nejméně jednoho roku. Spóry triaktinomyxonu jsou přenášeny vodními proudy, kde mohou infikovat lososovité kůže. Penetrace ryb těmito spory trvá jen několik sekund. Do pěti minut se do epidermis ryb dostal vak zárodečných buněk zvaný sporoplazma a během několika hodin se sporoplasma rozdělí na jednotlivé buňky, které se rozšíří rybou.
V rybách se jak intracelulární, tak extracelulární fáze reprodukují v její chrupavce asexuální endogenií , což znamená, že nové buňky rostou ze starých buněk. Poslední fází v rybách je vytvoření myxospory, která je tvořena sporogonií . Jsou uvolňovány do životního prostředí, když se ryby rozkládají nebo jsou konzumovány. Některé nedávné výzkumy naznačují, že některé ryby mohou za živa vyhánět životaschopné myxospory.
Myxospory jsou extrémně houževnaté: „bylo prokázáno, že spóry Myxobolus cerebralis mohou tolerovat zmrazení při −20 ° C po dobu nejméně 3 měsíců, stárnutí v bahně při 13 ° C po dobu nejméně 5 měsíců a průchod střevy štiky severní Esox lucius nebo kachní Anas platyrhynchos bez ztráty infekčnosti“na červy. Triaktinomyxony mají mnohem kratší životnost, přežívají 34 dní nebo méně, v závislosti na teplotě.
Patologie

Infekce M. cerebralis byly hlášeny z celé řady druhů lososovitých: osm druhů „atlantských“ lososovitých, Salmo ; čtyři druhy „tichomořských“ lososovitých, Oncorhynchus ; čtyři druhy char, Salvelinus ; lipan, Thymallus thymallus ; a huchen, Hucho hucho . M. cerebralis způsobuje poškození svých rybích hostitelů připojením spór triaktinomyxonu a migrací různých fází přes tkáně a podél nervů, stejně jako trávením chrupavky. Rybí ocas může ztmavnout, ale kromě lézí na chrupavce vypadají vnitřní orgány obecně zdravé. Mezi další příznaky patří deformace skeletu a „vířící“ chování (honění ocasu) u mladých ryb, o kterém se předpokládalo, že je způsobeno ztrátou rovnováhy, ale ve skutečnosti je způsobeno poškozením míchy a dolního mozkového kmene. Experimenty ukázaly, že ryby mohou zabíjet Myxobolus v jejich kůži (možná pomocí protilátek ), ale že ryby neútočí na parazity, jakmile migrují do centrálního nervového systému. Tato reakce se liší druh od druhu.
U T. tubifex uvolňování spór triaktinomyxonu ze střevní stěny poškozuje sliznici červa ; to se může stát tisíckrát u jednoho červa a věří se, že to narušuje vstřebávání živin. Spory se z červa uvolňují téměř výhradně, když je teplota mezi 10 ° C a 15 ° C, takže ryby v teplejších nebo chladnějších vodách jsou méně náchylné k infekci a míra infekce se sezónně liší.
Citlivost
Velikost ryb, věk, koncentrace spór triaktinomyxonu a teplota vody ovlivňují míru infekce v rybách, stejně jako druh příslušných ryb. Nemoc má největší dopad na ryby mladší pěti měsíců, protože jejich kostry nezkostnatěly . To činí mladé ryby náchylnější k deformitám a poskytuje M. cerebralis více chrupavek, kterými se mohou krmit. V jedné studii na sedmi druzích mnoha kmenů byl pstruh potoční a pstruh duhový (kromě jednoho kmene) po dvou hodinách expozice mnohem více zasažen M. cerebralis než jiné druhy, zatímco pstruh býk , losos Chinook , pstruh obecný a Arktický lipan byl nejméně zasažen. Zatímco pstruh potoční může ukrývat parazita, obvykle nevykazují žádné příznaky a tento druh mohl být původním hostitelem M. cerebralis . Tento nedostatek příznaků u pstruha obecného znamenal, že parazit byl objeven až poté, co byli v Evropě představeni nepůvodní pstruhové duhové.
Diagnóza
Mírnou nebo těžkou klinickou infekci ryb s vířivou nemocí lze pravděpodobně diagnostikovat na základě změn v chování a vzhledu přibližně 35 až 80 dní po počáteční infekci, ačkoli „zranění nebo nedostatek dietního tryptofanu a kyseliny askorbové může vyvolávat podobné příznaky“, takže konečná diagnóza může vyžadovat nalezení myxospor v chrupavce ryby. U těžkých infekcí může být k nalezení spór nutné pouze mikroskopické vyšetření chrupavky. U méně závažných infekcí nejběžnější test zahrnuje trávení kraniální chrupavky proteázami pepsin a trypsin (pepsin-trypsin digest-PTD) před hledáním spór. Hlava a další tkáně mohou být dále vyšetřeny pomocí histopatologie, aby se potvrdilo, zda umístění a morfologie spór odpovídá tomu, co je známo pro M. cerebralis . Sérologická identifikace spor ve tkáňových řezech pomocí protilátky vytvořené proti sporám je také možná. Identitu parazita lze také potvrdit pomocí polymerázové řetězové reakce k amplifikaci 415 párů genů 18S rRNA z M. cerebralis . Ryby by měly být vyšetřovány v životní fázi, která je nejvíce náchylná k parazitům, se zvláštním zaměřením na ryby v akvakulturních jednotkách.
Dopad

Přestože byl původně mírný patogen Salmo trutta ve střední Evropě a dalších lososovitých v severovýchodní Asii, zavedení pstruha duhového ( Oncorhynchus mykiss ) výrazně zvýšilo dopad tohoto parazita. Pstruh duhový, který nemá vrozenou imunitu vůči M. cerebralis , je obzvláště citlivý a může uvolnit tolik spor, že i odolnější druhy ve stejné oblasti, jako je S. trutta , se mohou přetížit parazity a způsobit 80–90% úhyn . Tam, kde se M. cerebralis etabloval, způsobil úbytek nebo dokonce eliminaci celých kohort ryb.
Dopad v Evropě
Dopad M. cerebralis v Evropě je poněkud snížen, protože tento druh je v této oblasti endemický, což dává původním populacím ryb určitý stupeň imunity . Pstruh duhový, nejcitlivější druh tohoto parazita, není původem z Evropy; úspěšně se množící divoké populace jsou vzácné, takže málo divokých pstruhů duhových je dostatečně mladých, aby byli náchylní k infekci. Na druhé straně jsou široce chovány pro obnovu sportovních rybářských vod a pro akvakulturu , kde má tento parazit největší dopad. V Evropě se osvědčily líhnutí a odchov, jejichž cílem je zabránit infekci potěrem pstruha duhového. Mezi tyto techniky patří líhnutí vajec ve vodě bez spór a chov plůdku do fáze „osifikace“ v nádržích nebo na závodních drahách. Tyto metody věnují zvláštní pozornost kvalitě vodních zdrojů, aby se zabránilo vniknutí spór během výměny vody. Fry se přesouvají do hliněných rybníků pouze tehdy, když jsou považovány za klinicky odolné vůči parazitům, poté, co dojde k osifikaci skeletu.
Dopad na Novém Zélandu
M. cerebralis byl poprvé nalezen na Novém Zélandu v roce 1971. Parazit byl nalezen pouze v řekách na Jižním ostrově, daleko od nejdůležitějších akvakulturních lokalit. Kromě toho druhy lososů komerčně akvakulturované na Novém Zélandu mají nízkou náchylnost k vířivým chorobám a nebylo také prokázáno, že by parazit ovlivňoval původní lososovité. Důležitým nepřímým účinkem přítomnosti parazitů je omezení karantény na vývoz produktů z lososa do Austrálie.
Dopad ve Spojených státech

M. cerebralis byl poprvé zaznamenán v Severní Americe v roce 1956 v Pensylvánii , který byl zavlečen infikovanými pstruhy dovezenými z Evropy, a neustále se šíří na jih a západ. Do 90. let byla vířivá choroba považována za zvládnutelný problém postihující pstruhy duhové v líhních. Nedávno se však etablovala v přírodních vodách států Rocky Mountain ( Colorado , Wyoming , Utah , Montana , Idaho , Nové Mexiko ), kde způsobuje těžkou úmrtnost v několika sportovních rybářských řekách. Některé proudy na západě USA ztratily 90% svých pstruhů. Vířivá nemoc navíc ohrožuje rekreační rybolov, který je důležitý pro odvětví cestovního ruchu, což je klíčová složka ekonomik některých západních států USA. Například „ pracovní skupina Montana Whirling Disease odhaduje, že lov pstruhů vygeneroval pouze v Montaně rekreační výdaje ve výši 300 000 000 USD“. Aby toho nebylo málo, některé druhy ryb, které M. cerebralis infikuje ( pstruh obecný , hrdlořez a ocelář ), jsou již ohroženy nebo ohroženy a parazit by mohl zhoršit jejich již tak nejisté situace. Z důvodů, které jsou špatně pochopeny, ale pravděpodobně mají co do činění s podmínkami prostředí, byl dopad na infikované ryby největší v Coloradu a Montaně a nejméně v Kalifornii , Michiganu a New Yorku.
Dopad v Kanadě
Whirlingova choroba byla poprvé detekována u ryb v Johnson Lake v národním parku Banff v květnu 2016. Laboratoře CFIA Labs potvrzeny v srpnu a Parks Canada oznámily vypuknutí 23. srpna 2016. Ačkoli byla poprvé objevena v Banffu, nemusí to být nutně místo vznikl a šířil se. Vláda Alberty v současné době odebírá vzorky a testuje ryby v 6 různých povodích (Peace River, Athabasca, North Saskatchewan, Red Deer, Bow a Oldman), aby zjistila, kam se nemoc rozšířila. Počáteční vzorky ryb byly shromážděny v roce 2016 a v současné době jsou zpracovávány vládou Alberty a laboratoří CFIA. Od zahájení testování byla detekována v řece Upper Bow a v květnu 2017 bylo potvrzeno, že vířivá choroba byla detekována také v povodí Oldman. Deklarace neznamená, že každá vnímavá populace finfish v povodí Bow a Oldman River je nakažena touto nemocí.
V důsledku nového prohlášení bude od CFIA vyžadováno povolení k domácímu pohybu u vnímavých druhů a konečných použití identifikovaných v programu pro kontrolu domácího pohybu, vektoru Tubifex tubifex , původci onemocnění Myxobolus cerebralis a/nebo souvisejících věcech infikovaných a nárazníkových oblastí Alberty. Rekreační a sportovní rybolov, včetně rybaření vedeného profesionálním průvodcem, nebude vyžadovat povolení CFIA.
Prevence a kontrola
Někteří biologové se pokusili odzbrojit spory triaktinomyxonu tím, že je předčasně vystřelí. V laboratoři způsobila předčasný výboj vlákna pouze extrémní kyselost nebo zásaditost , střední až vysoké koncentrace solí nebo elektrický proud; neurochemikálie, cnidarské chemosenzibilizátory a pstruhový hlen byly neúčinné, stejně jako anestetizované nebo mrtvé ryby. Pokud by mohly být spory odzbrojeny, nebyly by schopny infikovat ryby, ale k nalezení účinné léčby je zapotřebí dalšího výzkumu.
Některé kmeny ryb jsou odolnější než jiné, dokonce i v rámci druhů; používání rezistentních kmenů může pomoci snížit výskyt a závažnost vířivých chorob v akvakultuře. Existují také určité nepřímé důkazy, že populace ryb si může časem vyvinout odolnost vůči této chorobě. Akvakulturisté se navíc mohou vyhnout infekcím M. cerebralis tím, že nebudou chovat hliněné rybníky pro chov mladých ryb; to je chrání před potenciálně infikovanými tubificidy a usnadňuje likvidaci spór a oligochaetů pomocí filtrace, chlorace a ultrafialového bombardování. Aby se minimalizovala populace tubificidů, zahrnují techniky pravidelnou dezinfekci líhně nebo akvakulturních rybníků a chov malých pstruhů uvnitř ve vodě bez patogenů. Oběžné dráhy z betonu s hladkým povrchem nebo z umělé hmoty, které jsou udržovány čisté a bez kontaminované vody, udržují zařízení akvakultury bez této choroby.
Nakonec bylo prokázáno , že některá léčiva, jako je furazolidon , furoxon , benomyl , fumagillin , proguanil a clamoxyquine , brání rozvoji spor, což snižuje míru infekce. Jedna studie například ukázala, že krmení fumagillinem O. mykiss snížilo počet infikovaných ryb ze 73% na 100% na 10% až 20%. Tato léčba je bohužel považována za nevhodnou pro populace divokých pstruhů a ve studiích požadovaných pro schválení americkou správou potravin a léčiv nebyla nikdy prokázána žádná léčba drogami .
Rekreační a sportovní rybáři mohou pomoci zabránit šíření parazita tím, že nebudou přenášet ryby z jednoho vodního toku do druhého, nevyhazovat rybí kosti nebo vnitřnosti do žádné vodní plochy a zajistit, aby byly boty a boty před přesunem mezi různými těly čisté. z vody. Je třeba dodržovat federální, státní, provinční a místní předpisy o používání návnady .
Viz také
- Ceratomyxa shasta - další patogenní myxosporský parazit lososovitých
- Infekční anémie lososa (ISA) - virová infekce lososa atlantského
- Kudoa thyrsites - myxosporský parazit mnoha druhů, který způsobuje, že se tkáně ryb po smrti zkapalňují
- Tetracapsuloides bryosalmonae - záhadný myxosporean, který způsobuje u salmonidů „proliferativní onemocnění ledvin“
- Citlivost lososů na vířivou nemoc
Poznámky
externí odkazy
- Zpráva Světové obchodní organizace o australských omezeních dovozu lososa
- The Whirling Disease Initiative
- Mapy a data vířivých chorob
- Species Profile- Whirling Disease ( Myxobolus cerebralis ) , National Invasive Species Information Center, United States National Agricultural Library , uvádí obecné informace a zdroje pro vířivou chorobu
- Whirlingova choroba - Yellowstonský národní park (služba amerického národního parku)
- Whirlingova choroba - zastavte vodní stopaře
- Vířivá nemoc - Utah Division of Wildlife Resources
- Colorado Parks & Wildlife - Whirling Disease and Colorado's Trout
- Co je to Whirlingova choroba? - North Central Regional Aquaculture Center - Mohamed Faisal - Donald Garling
- Vířivá nemoc | Alberta.ca



