Oxid zinečnatý - Zinc oxide

|
|
| Jména | |
|---|---|
| Ostatní jména
Zinek bílý, kalamín, vlna mudrců, čínská bílá, květy zinku
|
|
| Identifikátory | |
|
3D model ( JSmol )
|
|
| ČEBI | |
| CHEMBL | |
| ChemSpider | |
| DrugBank | |
| Informační karta ECHA |
100,013,839 |
| Číslo ES | |
| 13738 | |
| KEGG | |
|
PubChem CID
|
|
| Číslo RTECS | |
| UNII | |
| UN číslo | 3077 |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Vlastnosti | |
| Zn O | |
| Molární hmotnost | 81,406 g/mol |
| Vzhled | Bílá pevná látka |
| Zápach | Bez zápachu |
| Hustota | 5,606 g / cm 3 |
| Bod tání | 1987 ° C (3585 ° F; 2247 K) (rozkládá se) |
| Bod varu | 1987 ° C (3585 ° F; 2247 K) (rozkládá se) |
| 0,0004% (17,8 ° C) | |
| Pásová mezera | 3,3 eV ( přímý ) |
| −27,2 · 10 −6 cm 3 /mol | |
|
Index lomu ( n D )
|
n 1 = 2,013, n 2 = 2,029 |
| Struktura | |
| Wurtzite | |
| C 6v 4 - P 6 3 mc | |
|
a = 3,2495 Á, c = 5,2069 Á
|
|
|
Vzorce jednotek ( Z )
|
2 |
| Čtyřboká | |
| Termochemie | |
|
Tepelná kapacita ( C )
|
40,3 J · K −1 mol −1 |
|
Standardní molární
entropie ( S |
43,7 ± 0,4 J · K −1 mol −1 |
|
Standardní entalpie
tvorby (Δ f H ⦵ 298 ) |
-350,5 ± 0,3 kJ mol −1 |
|
Gibbsova volná energie (Δ f G ˚)
|
-320,5 kJ mol −1 |
| Farmakologie | |
| QA07XA91 ( WHO ) | |
| Nebezpečí | |
| Bezpečnostní list | ICSC 0208 |
| Piktogramy GHS |

|
| Signální slovo GHS | Varování |
| H400 , H401 | |
| P273 , P391 , P501 | |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | 1436 ° C (2617 ° F; 1709 K) |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
|
LD 50 ( střední dávka )
|
240 mg/kg (intraperitoneální, krysa) 7950 mg/kg (krysa, orální) |
|
LC 50 ( střední koncentrace )
|
2500 mg/m 3 (myš) |
|
LC Lo ( nejnižší publikované )
|
2500 mg/m 3 (morče, 3–4 h) |
| NIOSH (limity expozice USA pro zdraví): | |
|
PEL (přípustné)
|
TWA 5 mg/m 3 (dým) TWA 15 mg/m 3 (celkový prach) TWA 5 mg/m 3 (resp. Prach) |
|
REL (doporučeno)
|
Prach: TWA 5 mg/m 3 C 15 mg/m 3 Dým: TWA 5 mg/m 3 ST 10 mg/m 3 |
|
IDLH (bezprostřední nebezpečí)
|
500 mg/m 3 |
| Související sloučeniny | |
|
Jiné anionty
|
Sulfid zinečnatý Selenid zinečnatý Telurid zinku |
|
Jiné kationty
|
Oxid kademnatý Oxid rtuťnatý |
|
Pokud není uvedeno jinak, jsou údaje uvedeny pro materiály ve standardním stavu (při 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Reference na infobox | |
Oxid zinečnatý je anorganická sloučenina se vzorcem Zn O . ZnO je bílý prášek, který je nerozpustný ve vodě. Používá se jako přísada do mnoha materiálů a produktů, včetně kosmetiky, potravinových doplňků, kaučuků, plastů, keramiky, skla, cementu, maziv, barev, mastí, lepidel, tmelů, pigmentů, potravin , baterií, feritů, retardérů hoření a -pomocné pásky. Ačkoli se přirozeně vyskytuje jako minerální zinekit , většina oxidu zinečnatého se vyrábí synteticky.
ZnO je širokopásmový mezerový polovodič ze skupiny polovodičů II-VI . Nativní doping polovodiče v důsledku uvolňování kyslíku nebo intersticiálů zinku je n-typu. Mezi další příznivé vlastnosti patří dobrá transparentnost, vysoká mobilita elektronů , široká pásmová mezera a silná luminiscence při pokojové teplotě . Díky těmto vlastnostem je ZnO cenný pro celou řadu nově se objevujících aplikací: průhledné elektrody v displejích z tekutých krystalů , energeticky úsporná nebo tepelně chránící okna a elektronika jako tenkovrstvé tranzistory a světelné diody .
Chemické vlastnosti
Čistý ZnO je bílý prášek, ale v přírodě se vyskytuje jako vzácný minerální zinek , který obvykle obsahuje mangan a další nečistoty, které propůjčují žlutou až červenou barvu.
Krystalický oxid zinečnatý je termochromní , při zahřívání na vzduchu přechází z bílé na žlutou a po ochlazení se vrací do bílé. Tato změna barvy je způsobena malou ztrátou kyslíku do prostředí při vysokých teplotách za vzniku nestechiometrického Zn 1+x O, kde při 800 ° C x = 0,00007.
Oxid zinečnatý je amfoterní oxid . Je téměř nerozpustný ve vodě, ale rozpustí se ve většině kyselin , jako je kyselina chlorovodíková :
- ZnO + 2 HCl → ZnCl 2 + H 2 O
Pevný oxid zinečnatý se také rozpustí v zásadách za vzniku rozpustných zinku:
- ZnO + 2 NaOH + H 2 O → Na 2 [Zn (OH) 4 ]
ZnO reaguje pomalu s mastnými kyselinami v olejích za vzniku odpovídajících karboxylátů , jako je oleát nebo stearát . ZnO tvoří cementové produkty, když je smíchán se silným vodným roztokem chloridu zinečnatého a ty jsou nejlépe popsány jako hydroxychloridy zinku. Tento cement byl použit ve zubním lékařství.
ZnO také vytváří materiál podobný cementu, když je ošetřen kyselinou fosforečnou ; ve stomatologii se používají související materiály. Hlavní složkou zinkofosfátového cementu vyrobeného touto reakcí je Hopeite , Zn 3 (PO 4 ) 2 · 4H 2 O.
ZnO se rozkládá na páry zinku a kyslík při teplotě přibližně 1975 ° C se standardním tlakem kyslíku. Při karbotermické reakci zahřívání uhlíkem přeměňuje oxid na páry zinku při mnohem nižší teplotě (kolem 950 ° C).
- ZnO + C → Zn (pára) + CO
Fyzikální vlastnosti
Struktura
Oxid zinečnatý krystalizuje ve dvou hlavních formách , hexagonální wurtzite a kubického zincblende . Struktura wurtzitu je nejstabilnější za okolních podmínek, a proto je nejběžnější. Formu zinku lze stabilizovat pěstováním ZnO na substrátech s kubickou mřížkovou strukturou. V obou případech jsou centra zinku a oxidu čtyřboká , nejcharakterističtější geometrie pro Zn (II). ZnO převádí na motiv skalní soli při relativně vysokých tlacích asi 10 GPa. Mnoho pozoruhodných lékařských vlastností krémů obsahujících ZnO lze vysvětlit jeho elastickou měkkostí, která je charakteristická pro čtyřboké koordinované binární sloučeniny blízké přechodu na oktaedrální struktury.
Šestiúhelníkové a zinkové směsi nemají žádnou inverzní symetrii (odraz krystalu vzhledem k jakémukoli danému bodu jej nepromění na sebe). Tato a další vlastnosti symetrie mřížky mají za následek piezoelektricitu hexagonálního a zinkového blinku ZnO a pyroelektricitu hexagonálního ZnO.
Hexagonální struktura má bod skupina 6 mm ( Hermann-Mauguin notace ) nebo C 6v ( Schoenflies notaci ), a prostorová skupina je P6 3 mc nebo C 6V 4 . Mřížkové konstanty jsou a = 3,25 Á a c = 5,2 Á; jejich poměr c/a ~ 1,60 se blíží ideální hodnotě pro hexagonální buňku c/a = 1,633. Jako ve většině materiálů skupiny II-VI je vazba v ZnO do značné míry iontová (Zn 2+ –O 2− ) s odpovídajícími poloměry 0,074 nm pro Zn 2+ a 0,140 nm pro O 2− . Tato vlastnost odpovídá spíše preferenční tvorbě wurtzitu než struktury směsi zinku, jakož i silné piezoelektřině ZnO. Kvůli polárním vazbám Zn-O jsou zinkové a kyslíkové roviny elektricky nabité. Aby byla zachována elektrická neutralita, tyto roviny rekonstruují na atomové úrovni ve většině relativních materiálů, ale ne v ZnO - její povrchy jsou atomově ploché, stabilní a nevykazují žádnou rekonstrukci. Studie využívající wurtzoidní struktury však kromě původu nábojů na rovinách ZnO vysvětlovaly původ plochosti povrchu a absenci rekonstrukce na povrchu wurtzitu ZnO.
Mechanické vlastnosti
ZnO je relativně měkký materiál s přibližnou tvrdostí 4,5 na Mohsově stupnici . Jeho elastické konstanty jsou menší než u příslušných polovodičů III-V, jako je GaN . Vysoká tepelná kapacita a tepelná vodivost, nízká tepelná roztažnost a vysoká teplota tání ZnO jsou pro keramiku prospěšné. Optický fonon E2 v ZnO vykazuje neobvykle dlouhou životnost 133 ps při 10 K.
Mezi tetraedrálně vázanými polovodiči bylo uvedeno, že ZnO má nejvyšší piezoelektrický tenzor, nebo alespoň jeden srovnatelný s GaN a AlN . Tato vlastnost z něj činí technologicky důležitý materiál pro mnoho piezoelektrických aplikací, které vyžadují velkou elektromechanickou spojku. Proto je ZnO ve formách tenkého filmu jedním z nejvíce studovaných rezonátorových materiálů pro tenkovrstvé hromadné akustické rezonátory .
Elektrické a optické vlastnosti
ZnO má při pokojové teplotě relativně velkou přímou mezeru pásma ~ 3,3 eV. Mezi výhody spojené s velkou mezerou pásma patří vyšší průrazné napětí, schopnost udržet velká elektrická pole, nižší elektronický šum a provoz při vysokých teplotách a vysokém výkonu. Pásmová mezera ZnO může být dále vyladěna na ~ 3–4 eV jeho legováním oxidem hořečnatým nebo oxidem kademnatým .
Většina ZnO má charakter n -typu , a to i při absenci úmyslného dopingu . Nestechiometrie je typicky původem charakteru n-typu, ale předmět zůstává kontroverzní. Bylo navrženo alternativní vysvětlení, založené na teoretických výpočtech, že za to mohou neúmyslné substituční vodíkové nečistoty. Řiditelného dopingu typu n lze snadno dosáhnout nahrazením Zn prvky skupiny III, jako je Al, Ga, In nebo nahrazením kyslíku prvky skupiny VII chlorem nebo jodem .
Spolehlivý doping typu ZnO typu p zůstává obtížný. Tento problém pochází z nízké rozpustnosti dopantů typu p a jejich kompenzace hojnými nečistotami typu n. Tento problém je pozorován u GaN a ZnSe . Měření typu p v „vnitřně“ materiálu typu n je komplikováno nehomogenitou vzorků.
Aktuální omezení p-dopingu omezují elektronické a optoelektronické aplikace ZnO, které obvykle vyžadují spojení materiálů typu n a p. Známé dopanty typu p zahrnují prvky skupiny I Li, Na, K; prvky skupiny V N, P a As; stejně jako měď a stříbro. Mnoho z nich však tvoří hluboké akceptory a při pokojové teplotě nevytváří významné vedení typu p.
Elektronová pohyblivost ZnO se silně mění s teplotou a má maximálně ~ 2000 cm 2 /(V · s) při 80 K. Údaje o pohyblivosti děr jsou vzácné s hodnotami v rozmezí 5–30 cm 2 /(V · s).
Disky ZnO, fungující jako varistor , jsou aktivním materiálem většiny svodičů přepětí .
Oxid zinečnatý je známý svými silně nelineárními optickými vlastnostmi, zejména ve velkém. Nelineárnost nanočástic ZnO lze doladit podle jejich velikosti.
Výroba
Pro průmyslové použití, oxid zinečnatý je produkován v množství 10 5 tun ročně tři hlavní procesy:
Nepřímý proces
V nepřímém nebo francouzském procesu se kovový zinek roztaví v grafitovém kelímku a odpaří se při teplotách nad 907 ° C (obvykle kolem 1000 ° C). Páry zinku reagují s kyslíkem ve vzduchu za vzniku ZnO, doprovázené poklesem teploty a jasnou luminiscencí. Částice oxidu zinečnatého jsou transportovány do chladicího potrubí a shromažďovány v pytlovině. Tato nepřímá metoda byla propagována společností LeClaire (Francie) v roce 1844, a proto je běžně známá jako francouzský proces. Jeho produkt obvykle sestává z aglomerovaných částic oxidu zinečnatého o průměrné velikosti 0,1 až několik mikrometrů. Podle hmotnosti se většina světového oxidu zinečnatého vyrábí francouzským způsobem.
Přímý proces
Přímý nebo americký proces začíná různými kontaminovanými zinkovými kompozity, jako jsou zinkové rudy nebo vedlejší produkty z hutě. Prekurzory zinku jsou redukovány ( karbotermální redukce ) zahříváním se zdrojem uhlíku, jako je antracit, za vzniku par zinku, které jsou následně oxidovány jako v nepřímém procesu. Vzhledem k nižší čistotě výchozího materiálu má konečný produkt také nižší kvalitu v přímém procesu ve srovnání s nepřímým.
Mokrý chemický proces
Malé množství průmyslové výroby zahrnuje mokré chemické procesy, které začínají vodnými roztoky solí zinku, ze kterých se vysráží uhličitan zinečnatý nebo hydroxid zinečnatý . Pevná sraženina se poté kalcinuje při teplotách kolem 800 ° C.
Laboratorní syntéza
Pro výrobu ZnO pro vědecké studie a specializované aplikace existuje řada specializovaných metod. Tyto metody lze klasifikovat podle výsledné formy ZnO (sypký, tenký film, nanodrát ), teploty („nízká“, která se blíží pokojové teplotě nebo „vysoká“, tj. T ~ 1000 ° C), typu procesu (depozice par nebo růst z roztoku) a další parametry.
Velké monokrystaly (mnoho centimetrů krychlových) lze pěstovat transportem plynu (depozice v plynné fázi), hydrotermální syntézou nebo růstem taveniny. Vzhledem k vysokému tlaku par ZnO je však růst z taveniny problematický. Růst přepravou plynu je obtížné kontrolovat, přičemž upřednostňuje hydrotermální metodu. Tenké vrstvy mohou být vyráběny nanášením chemických par , organokovových plynné fáze epitaxe , galvanizaci , pulzního laserového nanášení , pokovování rozprašováním , sol-gel syntézou, nanášení atomových vrstev , rozprašovací pyrolýzou, atd.
Běžný bílý práškový oxid zinečnatý lze v laboratoři vyrobit elektrolyzací roztoku hydrogenuhličitanu sodného se zinkovou anodou. Vyrábí se hydroxid zinečnatý a plynný vodík. Hydroxid zinečnatý se zahříváním rozkládá na oxid zinečnatý.
- Zn + 2 H 2 O → Zn (OH) 2 + H 2
- Zn (OH) 2 → ZnO + H 2 O
Nanostruktury ZnO
Nanostruktury ZnO lze syntetizovat do různých morfologií, včetně nanodrátů, nanorodů , tetrapodů, nanopásů, nanoflowerů, nanočástic atd. Nanostruktury lze získat většinou výše uvedenými technikami, za určitých podmínek a také metodou pára-kapalina-pevná látka . Syntéza se typicky provádí při teplotách asi 90 ° C v ekvimolárním vodném roztoku dusičnanu zinečnatého a hexaminu , přičemž druhý poskytuje základní prostředí. Některá aditiva, jako je polyethylenglykol nebo polyethylenimin, mohou zlepšit poměr stran nanodrátů ZnO. Doping nanodrátů ZnO byl dosažen přidáním dalších kovových dusičnanů do růstového roztoku. Morfologii výsledných nanostruktur lze vyladit změnou parametrů týkajících se složení prekurzoru (jako je koncentrace zinku a pH) nebo tepelného zpracování (jako je teplota a rychlost zahřívání).
Zarovnané nanovlákna ZnO na předem naočkovaných substrátech z nitridu křemíku , skla a galia byly pěstovány za použití vodných solí zinku, jako je dusičnan zinečnatý a octan zinečnatý v zásaditém prostředí. Předběžné očkování substrátů pomocí ZnO vytváří místa pro homogenní nukleaci krystalu ZnO během syntézy. Mezi běžné metody předběžného očkování patří tepelný rozklad krystalitů octanu zinečnatého in-situ , spincoating nanočástic ZnO a použití fyzikálních metod depozice par k nanášení tenkých vrstev ZnO. Předběžné očkování může být provedeno ve spojení s metodami vzorování shora dolů, jako je litografie elektronovým paprskem a nanosférická litografie, k určení nukleačních míst před růstem. Vyrovnané nanodrátky ZnO lze použít v solárních článcích citlivých na barvivo a v zařízeních pro emise v terénu.
Dějiny
Sloučeniny zinku pravděpodobně používali časní lidé, ve zpracovaných i nezpracovaných formách, jako barvu nebo léčivou mast, ale jejich složení je nejisté. Použití pushpanjanu , pravděpodobně oxidu zinečnatého, jako masky pro oči a otevřené rány, je zmíněno v indickém lékařském textu Charaka Samhita , myšlenka k datu od 500 př.nl nebo dříve. O mast z oxidu zinečnatého hovoří také řecký lékař Dioscorides (1. století n. L. ). Galen navrhl léčit ulcerující rakovinu oxidem zinečnatým, stejně jako Avicenna ve svém The Canon of Medicine . Používá se jako přísada do produktů, jako je dětský pudr a krémy proti vyrážkám z plenek , kalamínový krém, šampony proti lupům a antiseptické masti.
Římané vyráběli značné množství mosazi (slitina zinku a mědi ) již v roce 200 př. N. L. Cementačním procesem, kde měď reagovala s oxidem zinečnatým. Předpokládá se, že oxid zinečnatý byl vyroben zahříváním zinkové rudy v šachtové peci. Tím se uvolnil kovový zinek jako pára, která pak vystoupala po kouřovodu a kondenzovala jako oxid. Tento proces popsal Dioscorides v 1. století n. L. Oxid zinečnatý byl také získán z zinkových dolů v Zawar v Indii , pocházející z druhé poloviny prvního tisíciletí před naším letopočtem.
Od 12. do 16. století byl v Indii rozpoznáván a vyráběn zinek a oxid zinečnatý pomocí primitivní formy procesu přímé syntézy. Z Indie se výroba zinku v 17. století přestěhovala do Číny. V roce 1743 byla v Bristolu ve Velké Británii založena první evropská huť na zinek . Kolem roku 1782 Louis-Bernard Guyton de Morveau navrhl nahradit olověnou bílou oxid zinečnatý.
Hlavní použití oxidu zinečnatého (zinkového bílku) bylo v barvách a jako přísada do mastí. Zinková běloba byla v roce 1834 přijata jako pigment v olejomalbách, ale špatně se mísila s olejem. Tento problém byl vyřešen optimalizací syntézy ZnO. V roce 1845 vyráběla LeClaire v Paříži olejovou barvu ve velkém a do roku 1850 se v celé Evropě vyráběla zinková běloba. Úspěch zinkově bílé barvy byl dán jejími výhodami oproti tradičnímu bílému olovu: zinková běloba je na slunci v podstatě trvalá, není černaná sírovým vzduchem, je netoxická a ekonomičtější. Protože je zinková běloba tak „čistá“, je cenná pro vytváření odstínů jinými barvami, ale při smíchání s jinými barvami vytváří poměrně křehký suchý film. Například koncem 90. let 19. století a začátkem 20. století někteří umělci používali jako podklad pro své olejomalby zinkovou bělobu. U všech těchto obrazů se během let objevily trhliny.
V nedávné době byla většina oxidu zinečnatého používána v gumárenském průmyslu k odolnosti proti korozi . V 70. letech byla druhou největší aplikací ZnO fotokopie . Jako plnidlo byl na fotokopírovací papír přidán vysoce kvalitní ZnO vyrobený „francouzským procesem“. Tato aplikace byla brzy vytlačena titanem .
Aplikace
Aplikace práškového oxidu zinečnatého jsou četné a hlavní jsou shrnuty níže. Většina aplikací využívá reaktivitu oxidu jako prekurzoru jiných sloučenin zinku. Pro aplikace v oblasti vědy o materiálech má oxid zinečnatý vysoký index lomu , vysokou tepelnou vodivost, vazebné, antibakteriální a UV ochranné vlastnosti. V důsledku toho se přidává do materiálů a produktů včetně plastů, keramiky, skla, cementu, gumy, maziv, barev, mastí, lepidel, tmelů, výroby betonu , pigmentů, potravin, baterií, feritů, retardérů hoření atd.
Gumárenská výroba
50% až 60% využití ZnO je v gumárenském průmyslu. Oxid zinečnatý a kyselina stearová se používají při vulkanizaci kaučuku. ZnO aditivum také chrání kaučuk před plísněmi (viz lékařské aplikace) a UV zářením.
Keramický průmysl
Keramický průmysl spotřebovává značné množství oxidu zinečnatého, zejména v keramických glazurách a směsích frity. Relativně vysoká tepelná kapacita, tepelná vodivost a vysoká teplotní stabilita ZnO spojená se srovnatelně nízkým koeficientem roztažnosti jsou žádoucí vlastnosti při výrobě keramiky. ZnO ovlivňuje teplotu tání a optické vlastnosti glazur, smaltů a keramických formulací. Oxid zinečnatý jako sekundární tavidlo s nízkou roztažností zlepšuje pružnost glazur snížením změny viskozity v závislosti na teplotě a pomáhá předcházet tření a třesu. Substitucí ZnO za BaO a PbO se snižuje tepelná kapacita a zvyšuje se tepelná vodivost. Malé množství zinku zlepšuje vývoj lesklých a lesklých povrchů. V mírném až vysokém množství však vytváří matné a krystalické povrchy. Pokud jde o barvu, zinek má komplikovaný vliv.
Lék
Oxid zinečnatý ve směsi s asi 0,5% oxidu železa (Fe 2 O 3 ) se nazývá kalamín a používá se v kalamínovém mléku. Dva minerály, zinkit a hemimorfit , které byly historicky nazývají calamine . Po smíchání s eugenolem , ligandem , vzniká eugenol z oxidu zinečnatého , který má ve stomatologii aplikace jako výplňové a protetické prostředky .
Odrážející základní vlastnosti ZnO mají jemné částice oxidu deodorační a antibakteriální vlastnosti, a proto se přidávají do materiálů včetně bavlněné tkaniny, gumy, výrobků pro ústní hygienu a balení potravin. Vylepšený antibakteriální účinek jemných částic ve srovnání se sypkým materiálem není exkluzivní pro ZnO a je pozorován u jiných materiálů, jako je stříbro . Tato vlastnost vyplývá ze zvýšené povrchové plochy jemných částic.
Oxid zinečnatý se používá v ústních vodách a zubních pastách jako antibakteriální činidlo navržené k prevenci tvorby plaku a zubního kamene a ke kontrole zápachu z úst snížením těkavých plynů a těkavých sloučenin síry (VSC) v ústech. Spolu s oxidem zinečnatým nebo solemi zinku tyto produkty také běžně obsahují další aktivní složky, jako je cetylpyridiniumchlorid , xylitol , hinokitiol , silice a rostlinné extrakty .
Oxid zinečnatý se široce používá k léčbě různých kožních onemocnění, včetně atopické dermatitidy , kontaktní dermatitidy , svědění způsobeného ekzémem , vyrážky plenky a akné . Oxid zinečnatý se také často přidává do opalovacích krémů .
Používá se v produktech, jako je dětský pudr a bariérové krémy k léčbě vyrážky z plenek , kalamínový krém, šampony proti lupům a antiseptické masti. Je to také součást pásky (nazývaná „páska z oxidu zinečnatého“) používaná sportovci jako obvaz, aby se zabránilo poškození měkkých tkání během tréninku.
Oxid zinečnatý lze použít do mastí, krémů a pleťových vod k ochraně před spálením od slunce a jiným poškozením kůže způsobeným ultrafialovým světlem (viz opalovací krém ). Jedná se o nejširší spektrum absorbérů UVA a UVB, které je schváleno pro použití jako opalovací krém americkým úřadem pro kontrolu potravin a léčiv (FDA), a je zcela fotostabilní. Pokud se oxid zinečnatý používá jako přísada do opalovacích krémů , blokuje ultrafialové světlo UVA (320–400 nm) i UVB (280–320 nm) . Oxid zinečnatý a další nejběžnější fyzikální opalovací krém , oxid titaničitý , jsou považovány za nedráždivé, nealergenní a nekomedogenní . Zinek z oxidu zinečnatého se však do pokožky mírně vstřebává.
Mnoho opalovacích krémů používá nanočástice oxidu zinečnatého (spolu s nanočásticemi oxidu titaničitého), protože takové malé částice nerozptylují světlo, a proto nevypadají bílé. Nanočástice nejsou absorbovány do kůže více než částice oxidu zinečnatého běžné velikosti a jsou absorbovány pouze do nejvzdálenější vrstvy pokožky, ale ne do těla.
Nanočástice oxidu zinečnatého mohou zvýšit antibakteriální aktivitu ciprofloxacinu . Bylo ukázáno, že nano ZnO, který má průměrnou velikost mezi 20 nm a 45 nm, může zvýšit antibakteriální aktivitu ciprofloxacinu proti Staphylococcus aureus a Escherichia coli in vitro . Zesilující účinek tohoto nanomateriálu je závislý na koncentraci proti všem testovacím kmenům. Tento účinek může být způsoben dvěma důvody. Za prvé, nanočástice oxidu zinečnatého mohou interferovat s proteinem NorA, který byl vyvinut pro udělení rezistence bakteriím a má čerpací aktivitu, která zprostředkovává vypouštění hydrofilních fluorochinolonů z buňky. Za druhé, nanočástice oxidu zinečnatého mohou interferovat s proteinem Omf, který je zodpovědný za pronikání chinolonových antibiotik do buňky.
Cigaretové filtry
Oxid zinečnatý je součástí cigaretových filtrů . Filtr se skládá z dřevěné uhlí impregnované s oxid zinečnatý a oxid železitý odstraňuje značné množství kyanovodíku ( HCN ) a sirovodíku ( H 2 S ) z tabákového kouře bez ovlivnění jeho chuť.
Potravinářská přídatná látka
Oxid zinečnatý se přidává do mnoha potravinářských produktů, včetně snídaňových cereálií , jako zdroj zinku, nezbytné živiny . (Ke stejnému účelu se také používá síran zinečnatý .) Některé balené potraviny také obsahují stopová množství ZnO, i když nejsou určeny jako živina.
Oxid zinečnatý byl spojen s kontaminací dioxinů ve vývozu vepřového masa v chilské krizi vepřového masa v roce 2008 . Bylo zjištěno, že kontaminace je způsobena dioxiny kontaminovaným oxidem zinečnatým používaným v krmivech pro prasata.
Pigment
Zinková běloba se používá jako pigment v barvách a je více neprůhledná než lithopon , ale méně neprůhledná než oxid titaničitý . Používá se také v nátěrech na papír. Čínská bílá je speciální druh zinkové běloby používaný v uměleckých pigmentech . Použití zinkové běloby (oxidu zinečnatého) jako pigmentu v olejomalbě začalo v polovině 18. století. Částečně nahradila jedovatou olověnou bílou a používali ji malíři jako Böcklin , Van Gogh , Manet , Munch a další. Je také hlavní složkou minerálního make -upu (CI 77947).
UV absorbér
Mikronizovaný a nanorozměrový oxid zinečnatý a oxid titaničitý poskytují silnou ochranu před ultrafialovým zářením UVA a UVB a používají se v opalovacích mlécích a také v slunečních brýlích blokujících UV záření pro použití ve vesmíru a pro ochranu při svařování , podle výzkumu vědců z Jet Laboratoř pohonu ( JPL ).
Nátěry
Barvy obsahující prášek oxidu zinečnatého se již dlouho používají jako antikorozní nátěry kovů. Jsou zvláště účinné pro pozinkované železo. Železo je obtížné chránit, protože jeho reaktivita s organickými povlaky vede ke křehkosti a nedostatečné přilnavosti. Barvy na bázi oxidu zinečnatého si zachovávají svoji pružnost a přilnavost na takových površích po mnoho let.
ZnO vysoce n-typu dotovaného hliníkem , galliem nebo indiem je průhledný a vodivý ( průhlednost ~ 90%, nejnižší odpor ~ 10-4 Ω · cm). ZnO: Al povlaky se používají pro energeticky úsporná nebo tepelně chránící okna. Povlak propouští viditelnou část spektra dovnitř, ale buď odráží infračervené (IR) záření zpět do místnosti (úspora energie), nebo nepropouští IR záření do místnosti (tepelná ochrana), podle toho, na které straně okna je povlak.
Plasty, jako je polyethylen naftalát (PEN), lze chránit nanesením povlaku z oxidu zinečnatého. Povlak snižuje difúzi kyslíku s PEN. Vrstvy oxidu zinečnatého lze také použít na polykarbonát ve venkovních aplikacích. Povlak chrání polykarbonát před slunečním zářením a snižuje jeho rychlost oxidace a fotožloutnutí.
Prevence koroze v jaderných reaktorech
Oxid zinečnatý ochuzený o 64 Zn ( izotop zinku s atomovou hmotností 64) se používá v prevenci koroze v jaderných tlakovodních reaktorech . Vyčerpání je nutné, protože 64 Zn je transformováno na radioaktivní 65 Zn ozářením neutrony reaktoru.
Reforma metanu
Oxid zinečnatý (ZnO), se používá jako předběžného zpracování za účelem odstranění sirovodíku (H 2 S) ze zemního plynu po hydrogenaci jakékoliv síry sloučeniny známé ze stavu do reformeru metanu , který může způsobit otravu katalyzátoru. Při teplotách mezi asi 230-430 ° C (446-806 ° F), H 2 S je převeden do vody podle následující reakce:
- H 2 S + ZnO → H 2 O + ZnS
Po konzumaci oxidu zinečnatého se sulfid zinečnatý (ZnS) nahradí čerstvým oxidem zinečnatým.
Potenciální aplikace
Elektronika
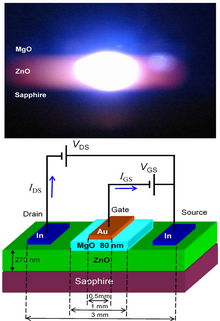

ZnO má širokou přímou mezeru v pásmu (3,37 eV nebo 375 nm při pokojové teplotě). Proto jsou jeho nejběžnější potenciální aplikace v laserových diodách a světelných diodách (LED). Některé optoelektronické aplikace ZnO se překrývají s GaN , které mají podobnou mezeru v pásmu (~ 3,4 eV při pokojové teplotě). Ve srovnání s GaN má ZnO větší energii vazby excitonu (~ 60 meV, 2,4násobek tepelné energie při pokojové teplotě), což má za následek jasné emise pokojové teploty ze ZnO. ZnO lze kombinovat s GaN pro LED aplikace. Například jako transparentní vodivá vrstva oxidu a nanostruktury ZnO poskytují lepší odpojení světla. Mezi další vlastnosti ZnO příznivé pro elektronické aplikace patří jeho stabilita vůči vysokoenergetickému záření a možnost vzorování mokrým chemickým leptáním. Díky radiační odolnosti je ZnO vhodným kandidátem pro vesmírné aplikace. ZnO je nejslibnějším kandidátem v oblasti náhodných laserů na výrobu elektronicky čerpaného zdroje UV laseru.
Špičaté špičky nanorodů ZnO vedou k silnému posílení elektrického pole. Proto je lze použít jako vysílače pole .
Jako transparentní elektrody se používají vrstvy ZnO dotované hliníkem . Složky Zn a Al jsou mnohem levnější a méně toxické ve srovnání s obecně používaným oxidem india a cínu (ITO). Jednou z aplikací, která začala být komerčně dostupná, je použití ZnO jako předního kontaktu pro solární články nebo displeje z tekutých krystalů .
Transparentní tenkovrstvé tranzistory (TTFT) lze vyrábět se ZnO. Jako tranzistory s efektem pole dokonce nemusí potřebovat křižovatku ap – n, čímž se zabrání dopingovému problému typu Z s ZnO. Některé z tranzistorů s efektem pole dokonce používají jako vodivé kanály nanorody ZnO.
Nanorodový senzor oxidu zinečnatého
Nanorobotické senzory oxidu zinečnatého jsou zařízení, která detekují změny elektrického proudu procházejícího nanodrátky oxidu zinečnatého v důsledku adsorpce molekul plynu. Selektivity na plynný vodík bylo dosaženo rozprašováním klastrů Pd na povrchu nanorodu. Přídavek Pd se jeví jako účinný při katalytické disociaci molekul vodíku na atomový vodík, což zvyšuje citlivost senzorového zařízení. Senzor detekuje koncentrace vodíku až 10 dílů na milion při pokojové teplotě, zatímco na kyslík nereaguje. ZnO byly použity jako imobilizační vrstvy v imunosenzorech, které umožňují distribuci protilátek v celé oblasti sondované měřicím elektrickým polem aplikovaným na mikroelektrody.
Spintronika
ZnO byl také zvažován pro aplikace spintroniky : pokud je dopován 1–10% magnetických iontů (Mn, Fe, Co, V atd.), ZnO by se mohl stát feromagnetickým , a to i při pokojové teplotě. Takový feromagnetismus pokojové teploty v ZnO: Mn byl pozorován, ale zatím není jasné, zda pochází ze samotné matrice nebo ze sekundárních oxidových fází.
Piezoelektřina
Ukázalo se, že piezoelektřina v textilních vláknech potažených ZnO je schopná vyrobit „nanosystémy s vlastním pohonem“ s každodenním mechanickým namáháním pohybem větru nebo těla.
V roce 2008 Centrum pro charakterizaci nanostruktur na Georgia Institute of Technology uvedlo, že vyrábí zařízení generující elektřinu (nazývané generátor pružné nabíjecí pumpy) dodávající střídavý proud natahováním a uvolňováním nanodrátů z oxidu zinečnatého. Tento minigenerátor vytváří oscilační napětí až 45 milivoltů, které přeměňuje téměř sedm procent použité mechanické energie na elektřinu. Výzkumníci použili dráty o délce 0,2–0,3 mm a průměru tří až pěti mikrometrů, ale zařízení bylo možné zmenšit na menší velikost.
Ve formě tenkého filmu byl ZnO prokázán v miniaturizovaných vysokofrekvenčních tenkovrstvých rezonátorech, senzorech a filtrech.
Li-ion baterie
ZnO je slibný anodový materiál pro lithium-iontovou baterii, protože je levný, biokompatibilní a šetrný k životnímu prostředí. ZnO má vyšší teoretickou kapacitu (978 mAh g -1 ) než mnoho jiných oxidů přechodných kovů, jako jsou CoO (715 mAh g -1 ), NiO (718 mAh g -1 ) a CuO (674 mAh g -1 ).
Bezpečnost
Jako potravinářská přídatná látka je oxid zinečnatý na seznamu FDA USA obecně uznávaného jako bezpečné látky nebo látky GRAS.
Samotný oxid zinečnatý je netoxický; je však nebezpečné vdechovat výpary oxidu zinečnatého, které vznikají při tavení a oxidaci zinku nebo slitin zinku při vysoké teplotě. K tomuto problému dochází při tavení slitin obsahujících mosaz, protože teplota tání mosazi se blíží bodu varu zinku. Vystavení oxidu zinečnatému ve vzduchu, ke kterému dochází také při svařování pozinkované (pozinkované) oceli , může mít za následek onemocnění zvané horečka kovových výparů . Z tohoto důvodu obvykle pozinkovaná ocel není svařena nebo se nejprve odstraní zinek.
Viz také
Reference
Citované zdroje
- Haynes WM, ed. (2011). CRC Handbook of Chemistry and Physics (92. ed.). Stiskněte CRC . ISBN 978-1439855119.
Recenze
- Özgür Ü, Alivov YI, Liu C, Teke A, Reshchikov M, Doğan S, et al. (2005). „Komplexní přehled materiálů a zařízení ZnO“ . Journal of Applied Physics . 98 (4): 041301–041301–103. Bibcode : 2005JAP .... 98d1301O . doi : 10,1063/1,1992666 .
- Bakin A, Waag A (29. března 2011). „Epitaxní růst ZnO“. V Bhattacharya P, Fornari R, Kamimura H (eds.). Comprehensive Semiconductor Science and Technology 6 Volume Encyclopaedia . Elsevier. ISBN 978-0-444-53143-8.
- Baruah S, Dutta J (únor 2009). „Hydrotermální růst nanostruktur ZnO“ . Věda a technologie pokročilých materiálů . 10 (1): 013001. Bibcode : 2009STAdM..10a3001B . doi : 10,1088/1468-6996/10/1/013001 . PMC 5109597 . PMID 27877250 .
- Janisch R (2005). „Přechodem kovem dotovaný TiO 2 a ZnO-současný stav pole“. Journal of Physics: Condensed Matter . 17 (27): R657 – R689. Bibcode : 2005JPCM ... 17R.657J . doi : 10,1088/0953-8984/17/27/R01 .
- Heo YW (2004). „Růst a zařízení nanodrátů ZnO“. Věda o materiálech a inženýrství: R: Zprávy . 47 (1–2): 1–47. doi : 10,1016/j.mser.2004.09.001 .
- Klingshirn C (2007). „ZnO: Od základů k aplikacím“. Physica Status Solidi B . 244 (9): 3027–3073. Bibcode : 2007PSSBR.244.3027K . doi : 10.1002/pssb.200743072 .
- Klingshirn C (duben 2007). „ZnO: materiál, fyzika a aplikace“ . ChemPhysChem . 8 (6): 782–803. doi : 10.1002/cphc.200700002 . PMID 17429819 .
- Lu JG, Chang P, Fan Z (2006). „Kvazi jednorozměrné materiály z oxidu kovu-syntéza, vlastnosti a aplikace“. Věda o materiálech a inženýrství: R: Zprávy . 52 (1–3): 49–91. CiteSeerX 10.1.1.125.7559 . doi : 10,1016/j.mser.2006.04.002 .
- Xu S, Wang ZL (2011). „Jednorozměrné nanostruktury ZnO: růst řešení a funkční vlastnosti“. Nano výzkum . 4 (11): 1013–1098. CiteSeerX 10.1.1.654.3359 . doi : 10,1007/s12274-011-0160-7 . S2CID 137014543 .
- Xu S, Wang ZL (2011). „Oxidová nanodrátová pole pro světelné diody a piezoelektrické sběrače energie“. Čistá a aplikovaná chemie . 83 (12): 2171–2198. doi : 10,1351/PAC-CON-11-08-17 . S2CID 18770461 .
externí odkazy
- Vlastnosti zinku
- Mezinárodní karta chemické bezpečnosti 0208 .
- Kapesní průvodce NIOSH k chemickým nebezpečím .
- Oxid zinečnatý v databázi vlastností pesticidů (PPDB)
- Zinkově bílý pigment na ColourLex






